-
遺伝子改変マウス
とは01
-
個体レベルのin vivo解析の重要性
02
-
トップレベルのノックアウトマウス作製技術
03
-
汎用性の高い可変型遺伝子トラップ法
04
-
疾患モデルマウス
05
-
ゲノム編集(CRISPR/Cas9)技術
06
-
可視化マウス
07
-
究極のモデル:ヒト化マウス
08
01. 遺伝子改変マウスとは:遺伝子導入マウスと遺伝子破壊(ノックアウト)マウス
トランスジェニック社の事業の礎のひとつが遺伝子改変マウス作製技術です。遺伝子改変マウスは、個体における個々の遺伝子の機能の解析、遺伝子と病態の関連の解明、病態モデルマウスの作製など、様々な基礎研究分野のみならず、創薬につながる研究においても新情報をもたらしうる貴重な生命資源となっています。遺伝子改変マウスには、遺伝子導入マウスと遺伝子破壊(ノックアウト)マウスが含まれますが、前者は遺伝子を過剰にあるいは異所的に発現させる技術です。遺伝子破壊マウスは、文字通り特定の遺伝子を完全破壊したり、小さい変異を導入したりする技術です。
02. 個体レベルのin vivo解析の重要性
タンパク質の機能は、試験管内や培養した細胞を使って調べることができ、このようなin vitroの研究により、それぞれのタンパク質がそれ自体でどのような働きをするのか、多くのことがわかってきました。しかし、生物個体では多くのタンパク質が絡み合い、干渉しあって機能しています。したがって、それぞれのタンパク質が生物の個体でどのような働きを行って高次生命現象を成り立たせているかは、in vivoつまり個体レベルで観察あるいは解析しなければわかりません。実際、ノックアウトマウスの20-30%では、表現型の異常は出現しないと言われています。表現型がでないからといって不必要だとは断言できませんが、一つなくなっても他の遺伝子が代償するという、フェイルセーフシステムが働くからです。つまり、in vitroで得たデータは、in vivoで再確認する必要があります。当社は、in vivo解析に強みを持っています。
03. トップレベルのノックアウトマウス作製技術
特定のタンパク質を作り出す遺伝子を破壊した生物を作り、その時に生物個体に何が起こるかを調べることによって、遺伝子とそこから作り出されるタンパク質の働きを解析するリバースジェネティクスと呼ばれる手法があります。このリバースジェネティクスの一つの方法が"ノックアウトマウス"の作製、解析です。個体レベルでの実験を行う際には、何らかの生物を使用する必要があります(モデル生物)。特にヒトについて知ろうとすれば、ヒトに近い哺乳類を用いることになります。哺乳類の中でもマウスは、小さく多産な動物であり、また二十日鼠というように妊娠期間が約20日間と比較的一世代の期間が短いことから、古くから実験動物としてよく使われてきました。さらに近年の全ゲノム配列決定の結果から、ヒトの遺伝子の99%はマウスでも相当する遺伝子が存在することが明らかとなり、マウス個体での研究結果からヒトにおける遺伝子の役割を外挿することが可能であると考えられます。
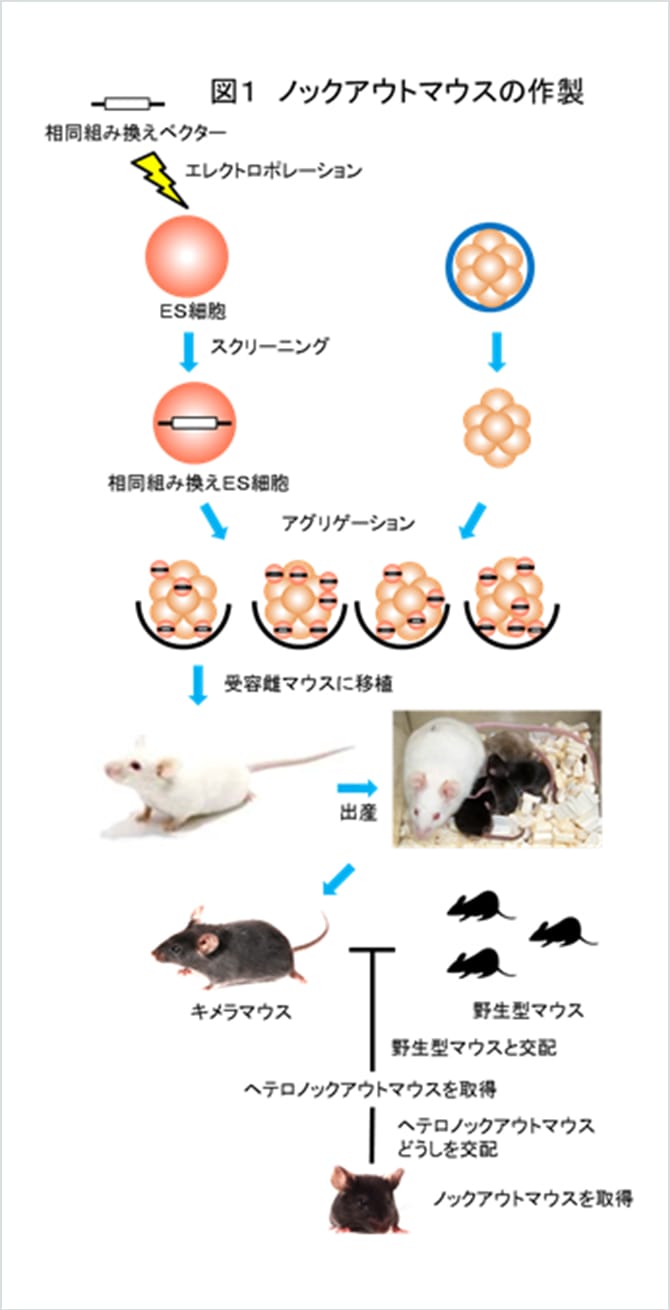
"ノックアウトマウス"は特定の遺伝子を破壊したマウスです。ノックアウトマウスはES細胞(胚性幹細胞、Embryonic Stem cells)と相同遺伝子組換え法の開発により1989年に初めて作製されました。ES細胞はマウス胎児が受精卵から発生する初期の時期である胚盤胞から樹立された細胞株で、ES細胞を再び胚盤胞に混ぜて発生させると、誕生したマウスはES細胞由来の組織を持つキメラマウスとなることが示されました。キメラマウスからはさらに交配によりES細胞由来の子孫を得られることが明らかとなり、すなわちES細胞で遺伝子変異をおこすことができれば、それを持ったマウス系統を作製することが可能となりました。ES細胞中の目的の遺伝子を破壊するために用いられる手法が、相同遺伝子組換え法です。この方法では、ES細胞を薬剤耐性とする遺伝子の両側にゲノムと相同性を持つ領域をつないだターゲティングベクターと呼ばれるDNAを作製します。ターゲティングベクターをES細胞内に導入しますと、ベクターとゲノムの相同性を持つ領域で組換えが起こり、薬剤耐性遺伝子がゲノム中に挿入されます。この挿入により、目的とする遺伝子の情報が正しく読まれない状態を作り出し、その遺伝子だけを破壊することができます。この手法は1989年以降、個体レベルでの遺伝子解析のために広く使われるようになりました。ノックアウトマウス作製法の開発者であるMartin Evans博士、Oliver Smithies博士、Mario Capecchi博士には2007年にノーベル医学・生理学賞が授与されています。実際の遺伝子改変マウスの作り方は、図1に示したようなものとなります。ゲノムデータベース上の情報をもとに、ターゲティングベクターをDNAクローニングの手法で作製し、ES細胞にエレクトロポレーションという手法で導入します。想定通りES細胞の遺伝子中にターゲティングベクターが挿入されたものをスクリーニングによって選択し、得られたES細胞を、野生型マウスの胚とアグリゲーションという手法により混合して受容雌マウスに移植します。ここから生まれてくるのがキメラマウスです。キメラマウスを野生型マウスと掛け合わせ、ES細胞に導入したターゲティングベクター由来の変異が次世代に伝われば、ノックアウトマウスが作製できたことになります。
トランスジェニック社では、2000年よりノックアウトマウス作製を受託事業として開始し、この分野での実績を積んできており、作製効率はトップレベルにあります。現在は、ES細胞と相同遺伝子組換えを用いた技術を応用して、生まれた時から遺伝子が破壊されたノックアウトマウスを作り出すだけでなく、臓器特異的、時期特異的に遺伝子破壊が可能となるマウス(コンディショナルノックアウトマウス)、本来発現するものとは別の遺伝子を発現するようにしたマウス(ノックインマウス)など、様々な遺伝子改変マウスの作製を行っています。当社では研究者の方とご相談させていただきながら、生命現象の解明に役立つマウスの作製を行っています。
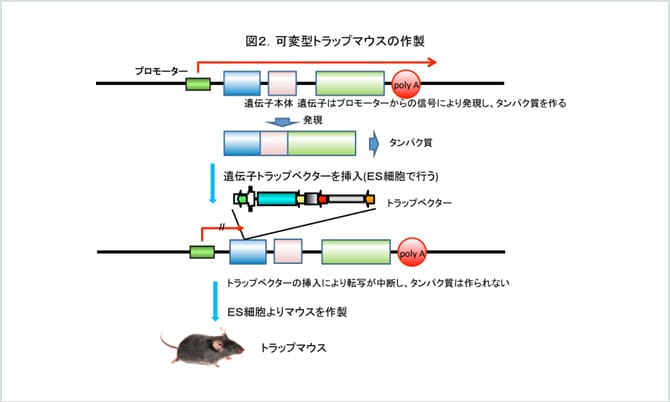
04. 汎用性の高い可変型遺伝子トラップ法
ES細胞を用いたもう一つのマウスの遺伝子破壊法として、遺伝子トラップ法があります。トランスジェニック社では可変型遺伝子トラップ法を独自の基盤技術として有しています(図2)。それぞれの遺伝子からタンパク質がいつ、どこで、どのくらい合成されるかは、生物にとって非常に重要です。この遺伝子発現の制御は、遺伝子の中でタンパク質となる情報を持つ領域よりも上流にあるプロモーターと呼ばれる配列によって行われています。また人工的にプロモーターを持たない遺伝子を、あるプロモーター配列の下流につなぐと、その遺伝子からタンパク質が合成されます。一方、一つのタンパク質になるための遺伝子上の情報には終わりがなければなりません。それを担っているのがPoly(A)と呼ばれる配列です。つまり、Poly(A)があるとそれより下流の情報は読まれずタンパク質合成はストップすることになります。可変型遺伝子トラップ法においては、プロモーター配列を含まない薬剤耐性遺伝子とPoly(A)を含んだ塩基配列をもつ可変型トラップベクターをES細胞に導入します。可変型トラップベクターはランダムにES細胞ゲノムに挿入され、もし挿入点がタンパク質情報をコードする初めの方の領域にあれば、挿入部位より下流となる遺伝子領域からのタンパク質合成はPoly(A)により妨げられ、結果としてタンパク質の合成ができない遺伝子破壊細胞となります。可変型トラップベクターの配列がわかっているので、挿入された遺伝子を同定することができ、また、遺伝子をランダムに破壊することにより、遺伝子破壊マウスの大規模な作製が可能となります。さらに可変型トラップベクターには、遺伝子の置き換えができるようなメカニズムが盛り込まれており、これによってマウスの遺伝子をヒトの遺伝子で置換したり、loxPを挿入して条件的アレルを容易に作製できます。
トランスジェニック社では、この独自技術である可変型遺伝子トラップ法により作製した遺伝子改変マウスのシリーズをTG Resource Bankとして、どなたでも検索、購入可能な遺伝子破壊マウスのライブラリーとして提供しています。これらの中から後述する肥満モデルマウスのような新しい疾患モデル動物もみつかり、今後も表現型からの解析により、有用な生命資源となることが期待されます。
05. 疾患モデルマウス:治療法の開発への応用
現在、遺伝子改変マウスの作製と解析は、遺伝子の機能を解析するためになくてはならない手法となっています。なかでも、ヒトで見つかった疾患に関与する遺伝子のマウスを用いた機能解析は、疾患が起こるメカニズムを知るために非常に重要な役割を担っています。ヒトの疾患に類似の症状を呈する動物は、疾患モデルマウスとして、治療法や予防法を開発するために用いることもできます。例えば、トランスジェニック社では、乳がん、肥満、睡眠障害といった疾患や病態をおこすマウスを販売しています。これらのマウスを用いることにより、それぞれの疾患や病態がどのように起こるか、またどのようにすれば防げるかなどの解析を行うことができます。ヒトの疾患にはまだその発症機構がわからず、科学的根拠に基づく治療法がないものが多くあります。当社では、少しでも病気の克服に役に立ち、人々の健康と豊かな暮らしの実現に貢献するために、今後も新しい疾患モデル動物の開発、導入を行っていきます。
06. ゲノム編集(CRISPR/Cas9)技術:遺伝子改変マウス作製における高効率化と高速化
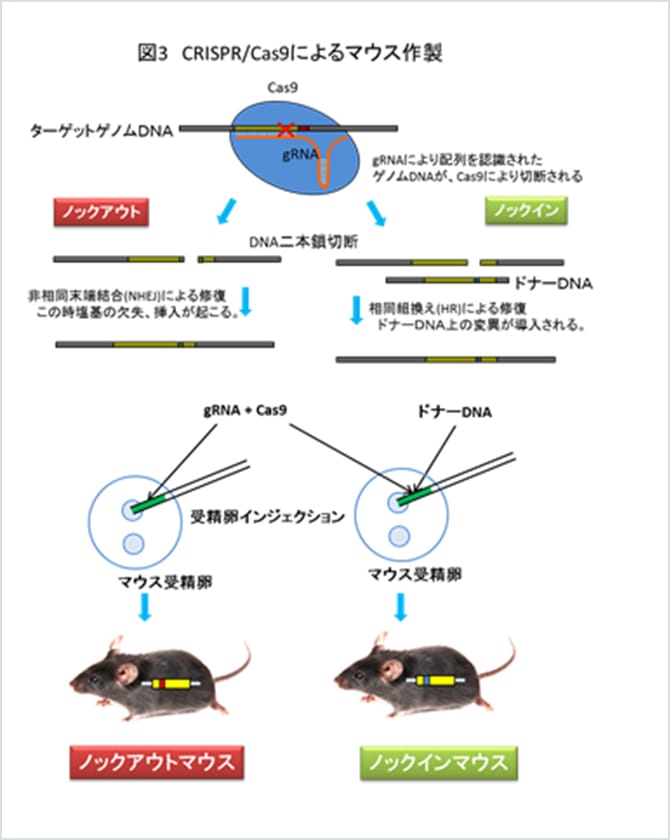
近年、新たな遺伝子改変技術として脚光を浴びてきているのがゲノム編集技術です。ゲノムは、細胞に含まれる遺伝子全体を指します。このゲノムを任意の場所で編集して、そこに存在する遺伝子の持つ情報を改変しようとするのがゲノム編集技術です。
ゲノム編集技術では、ゲノムを切断する酵素を用いてゲノムを任意の場所で切断します。すると細胞は切れたゲノムを修復しようとします。この修復の際に起こるエラーを利用すると、ゲノムの切れた部分を改変することができます。現在最もよく使われているゲノム編集技術が、CRISPR/Cas9システムです。CRISPR/Cas9は、細菌が持つ外敵を排除する獲得免疫機構を利用したもので、細菌はこの機構を利用して、外敵のゲノムを認識し、Cas9という酵素を利用して切断します。この認識、切断を人工的に細胞のゲノムに対して適用することによって遺伝子改変が可能となりました。図3上に示したように、ターゲットとなるゲノム領域のDNA配列を認識するガイドRNA (gRNA)を作製します。gRNAとCas9を共に細胞に導入すると、gRNAによって認識されたゲノム領域にCas9が結合し、ゲノムを切断します。切断されたゲノムは細胞が持つ非相同末端結合(NHEJ)と呼ばれる修復能力により修復されますが、この時塩基の欠失や挿入が起こります(図3左)。これにより、その部分に存在する遺伝子の情報が改変されたマウスを得ることができます。また、切断されたゲノム領域と相同な領域を持つドナーDNAに任意の変異を入れて加えると、修復がドナーDNAの情報をもとに行われるため、任意の変異をゲノム中に導入することも可能です(図3右)。2013年にはCRISPR/Cas9を用いて、マウスの受精卵に注入することによりノックアウトマウスが得られることが報告されました(図3下)。この方法ではターゲティングベクターを作る必要も、ES細胞を使用する必要もなく、より簡便に、1世代速く(約3ヶ月)ノックアウトマウスを作製することができます。また、ES細胞における相同組換え効率も格段に向上させることが分かっており、これまで不可能だった遺伝子の破壊も可能になっています。トランスジェニック社では、CRISPR/Cas9によるゲノム編集技術を開発したBroad Instituteよりライセンシングを受け、CRISPR/Cas9を用いた遺伝子改変マウス作製受託を開始いたしました。当社では、CRISPR/Cas9を用いたノックアウトマウスの作製だけでなく、ヒトの病態に関連するような1塩基の変異の導入や、多箇所の同時変異導入など、様々な新しい遺伝子改変マウス作製のアイディアにチャレンジしています。この技術の導入により、これまでは不可能であった、あるいは非常に困難であったような遺伝子改変のストラテジーが現実のものとなってきており、新しい情報をもたらしうる生命資源としての遺伝子改変動物作製の可能性が大幅に広がってきています。
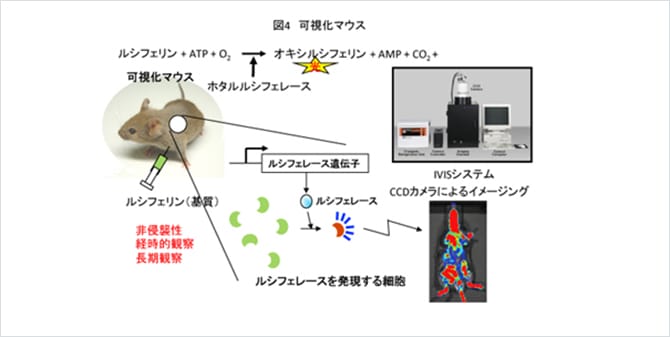
07. 可視化マウス:生きたまま病態を観察
疾患を起こしたマウスの解析には、そのマウスを解剖して調べることが必要となります。しかし、近年、生きているマウスで病態を定量的に視る技術が開発されました。これが可視化マウスです(図4)。可視化マウスでは、病態が生じるとルシフェレースというタンパク質が作られるような仕組みを、遺伝子改変マウス作製技術を利用して導入してあります。ルシフェレースはホタルが光るときの反応を行う酵素で、ルシフェリンという基質と反応して光を出します。マウスの体内で病態が発症し、ルシフェレースが作られているマウスに、ルシフェリンを投与すると、その病態部分が光ります。この光は高感度のCCDカメラで検出することができます。この方法ですと、生きているマウスの体内で進行している病態を光として検出することができますので非侵襲性で、また同じマウスで経時的に繰り返し、長期的に観察することも可能となります。トランスジェニック社では、病態可視化マウスとして、細胞ストレス、炎症を可視化するマウスを病態可視化マウスとして販売しています。可視化技術は比較的新しい技術であり、新しい疾患モデル動物として、これから多く使われていくものと考えています。
08. 究極のモデル:ヒト化マウス
■臓器ヒト化マウス
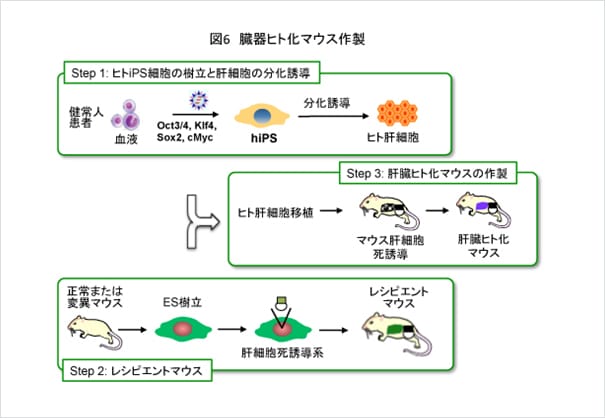
ヒトとマウスでは、遺伝子の種類はほぼ同じでも、産生されるタンパク質のアミノ酸配列は同じではありません。多くのタンパク質は、他のタンパクと相互作用して機能を発揮します。したがって、ヒト疾患の原因遺伝子をマウスに導入したからといって、同じ表現型がでるとは限りません。薬剤代謝はヒトとマウスで大きく異なります。肝臓においても、ヒトとマウスで発現している遺伝子の発現量が異なりますし、タンパク質アミノ酸配列が異なります。似て非なるものなのです。これがマウスモデルの限界と言われています。それを克服できるのでしょうか、あるいはどうすれば克服できるのでしょうか。答えは、遺伝子レベル、細胞レベル、臓器・組織レベルでのヒト化です。遺伝子レベルのヒト化は、トランスジェニック社が特許を持っている可変型組換え法を用いて、マウス遺伝子をヒト遺伝子置換することができます。また、CRISPR/Cas9法を使用しても可能です。しかし、一つ一つの遺伝子をヒト化して行くのは大変です。そこで臓器を丸ごとヒト化することが必要になってきています。マウス個体はそのままに、望む臓器だけをヒト化できる技術があれば、理想的な疾患モデルの作製が可能で、病因・病態解析はもちろんのこと、治療法の開発にも応用可能です。トランスジェニック社では、①ヒトiPS細胞から分化した細胞の誘導、②それを移植するためのレシピエントマウス、③前期の①と②を用いての臓器ヒト化マウスの開発に取組んでいます(図6)。
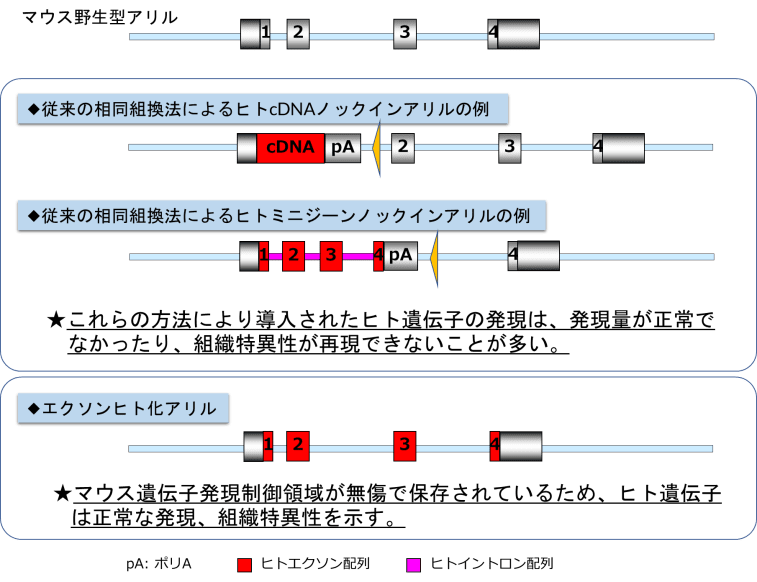
■遺伝子(エクソン)ヒト化マウス
「エクソンヒト化マウス」は、マウス遺伝子のイントロンはマウスの塩基配列を保持したままでエクソンだけがヒトの塩基配列を保持するエクソンヒト化マウスを作製する技術です。
従前の相同組換え法を利用したヒトDNA導入マウスでは、遺伝子発現制御機能が損なわれていることからヒト遺伝子の発現量が高値であったり低値であったりと、必ずしも正常ではなく、また、発現の組織特異性も異なるなど多くの欠点がありました。そのため、従来法で作製されたヒトDNA導入マウスでは、疾患モデルとして病態解析には使用できるものの、治療法の開発とその有効性の検証に使用するにあたっては、正常な発現量と発現パターンが求められることから、病態モデルとしては限界がありました。
エクソンヒト化マウス技術では、エクソンはヒト化している一方で、イントロンはマウスの塩基配列を保持し遺伝子発現制御領域が保存されていることから、ヒトの遺伝子発現パターンが量的にも、組織特異的にも正常に発現されることが可能となります。このことから、この技術を用いて作製されたヒト疾患モデルマウスは、核酸医薬等の薬剤及び遺伝子治療の効果をみる上で極めて有用と考えられます。