肝臓ヒト化マウスの歴史 第2話
意外なきっかけ
肝臓ヒト化マウス作製に至るきっかけは、肝臓ヒト化マウスとは何の関係もない血液凝固ー線溶系の研究のためのurokinase 型のプラスミノーゲンアクチベーター (plasminogen activator: PA)のトランスジェニック(Tg)マウス作製から始まりました。本稿では、「Heckel et al. Cell 62:447-456, 1990」の論文を紹介します。ただ凝固ー線溶系(図1)のことを詳しく紹介するのが目的ではありませんので、このあたりは必要なことにとどめたいと思います。
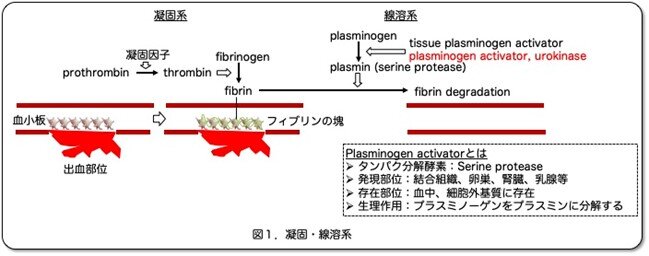
生体は、血管が障害されて出血が起こると血小板がやってきて栓をするとともに凝固系が働いてフィブリン(fibrin)の塊を作り出血を止めようとします。血管が修復されると、線溶系によりフィブリン塊を溶解しもとの組織になります。線溶系では、プラミノーゲン(plasminogen)がプラスミノーゲンアクチベーター(plasminogen activator: PA)により活性のあるプラスミン(plasmin)となり、これはタンパク分解酵素(serine protease)でありフィブリンを分解します。PAには2種類ありtissue-type PA (tPA)とurokinase-type PA (uPA)です。いずれも血漿中にほぼ同量存在し、このうちtPAが生理的な線溶に重要と考えられています。しかし、この血液凝固ー線溶系は結構複雑ですので、in vitroでの研究は困難です。
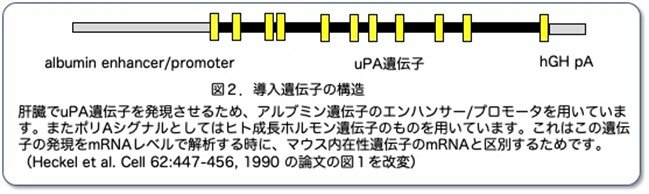
そこでマウス個体でその機能を明らかにするため、アルブミンプロモーターを接続したuPA遺伝子(図2)をマウスの受精卵に注入し、合計183匹のマウスが生まれました。その中から導入遺伝子を1コピー以上保有しているファウンダーマウス(F0)を56匹得ました。F0マウスが56匹というのはとてつもない数で、それぞれから交配によりF1(仮に10匹とします)を作製すると560匹になります。この560匹中からトランスジーンが伝わったかどうかをスクリーニングし、ポジティブなF1(理論上は50%)280匹得て、このF1からさらにF2を得るのですが、1匹のF1から10匹のF2として合計2800匹を作製し再びスクリーニングして1400匹のポジティブなF2を得ることができます。1ケージに5匹入れたとしても280ケージが必要です。仮に1部屋に6ラックが、1ラック50ケージが入ったとして1部屋を独占することになります。また、尻尾を切断してそこからDNAを抽出し、ジェノタイピングを行わなければなりませんが、これも本数が増えると膨大な作業です。Tgマウスの実験はあっという間に膨大な手間とコストがかかるということを理解していただけると思います。余談ですが、系統維持も含めてこのような作業はトランスジェニックのグループ会社に依頼し、余った時間を次の研究課題の構想、問題点の整理や実験計画の立案等に使うことをお勧めします。
56匹のF0マウスのうち17匹で生後2日の間に体内での出血が確認されました。13匹は消化管へ、4匹は腹腔内への出血で、その後黄疸が出現し10時間以内にこれらのマウスが死亡しました。
出血とuPA導入遺伝子の発現との関係を調べるため、罹患Tgマウスと年齢をマッチさせた対照マウスから組織と血漿のサンプルを採取し、導入遺伝子産物が調べられました。罹患した新生児マウスの肝臓におけるTg mRNAレベルは、細胞あたり6500分子と高値でしたが、非Tgマウスでは内因性uPAでは10分子未満でした。一方、肝臓のプラスミノーゲンmRNAはTgマウスでも非Tgマウスでも等しく豊富でした。血漿中のuPA濃度は、Tgマウスでは極めて高く、非Tgの新生児ではほとんど検出されませんでした。また、血漿中のTg uPA活性は肝Tg mRNAのレベルに相関しているようでした。しかし、Tgのうち出血群と非出血群との間に差はなく、この活性と出血とは相関していませんでした。
その後の解析結果が詳しく書かれていますが、要約すると以下のとおりです。
- 腸のサンプルではTg uPAの発現はすべて陰性で、腸での出血との因果関係はありませんでした。
- 肝臓のTg uPAのmRNA濃度および血漿中のuPA濃度は胎児で一番高く、年齢とともに減少傾向がありました。
- 血小板数はTgではコントロールと比較して低くなくむしろやや増加傾向にありました。よって、Tgでの出血の原因は、血小板の減少によるものではないと考えられます。
- 自然凝固時間を調べると、非Tgマウスでは2分以内に凝固しましたが、Tgマウスでは出血群も非出血群も30分以上経っても凝固しませんでした。トロンビンを添加した凝固時間も調べられましたがTgマウスでは出血群も非出血群も同じように全例凝固時間が30分以上であり、出血の有無とトロンビンを介した凝固時間は関係がありませんでした。ただ、Tgマウスが21日齢になってから、トロンビンによる血栓形成が再現され回復するようになりました。つまり、血液凝固機能の喪失は出血の素因となる可能性が高いが、出血の表現型を引き起こすには不十分であると思われました。
- Tgマウスのフィブリノゲンは新生児ではコントロールの10~20%、6日目では30%で、フィブリノゲンレベルが低下しています。このことは、Tgマウスが年をとるにつれて、血液凝固機能が徐々に回復することを示唆しています。しかし、出血の有無とフィブリノゲンレベルとは相関がなく出血の原因は説明できていません。
ということで、Tgマウスが出血したりしなかったりする理由は不明のままです。なんともフラストレーションがたまる実験で、研究者にとっては実験を中止するか継続するか悩ましい決断を迫られる場面です。
系統樹立
さてここからが主題です。肝臓ヒト化マウス作製のために必要なレシピエントマウスの樹立に向けてどのようにマウス系統が選別されたかについて解説します。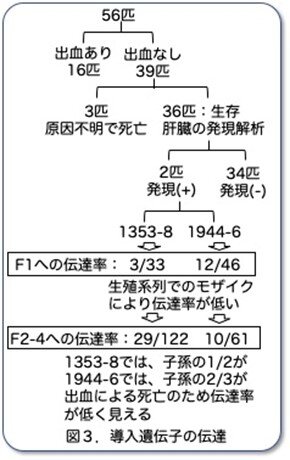 56匹のF0のうち39匹は出血せず、そのうち3匹は新生児期に原因不明で死亡しています。残りの36匹のF0マウスそれぞれから4週齢で肝臓を部分肝切除し、導入遺伝子の発現を調べたところ、2匹だけがTg mRNAを含んでいましたが、アッセイのバックグラウンドに近いレベルであったそうです。発現もごく少量で出血という表現型もない状況だと、もし企業なら普通はここで諦めて研究は中止することが多いと思います。それにもかかわらず、一見無駄に見える研究を続行し、最後に結果を出すというのが基礎研究の醍醐味かもしれません。これらのマウス(1353-8と1944-6と命名)は交配され、その子孫(F1)への導入遺伝子の伝達について解析されました。離乳時に解析したところ、1353-8のF1は33匹中3匹、1944-6のF1は46匹中12匹がTg遺伝子を受け継いでおり、伝達率の悪さから2匹とも生殖細胞系列モザイクと思われました。
56匹のF0のうち39匹は出血せず、そのうち3匹は新生児期に原因不明で死亡しています。残りの36匹のF0マウスそれぞれから4週齢で肝臓を部分肝切除し、導入遺伝子の発現を調べたところ、2匹だけがTg mRNAを含んでいましたが、アッセイのバックグラウンドに近いレベルであったそうです。発現もごく少量で出血という表現型もない状況だと、もし企業なら普通はここで諦めて研究は中止することが多いと思います。それにもかかわらず、一見無駄に見える研究を続行し、最後に結果を出すというのが基礎研究の醍醐味かもしれません。これらのマウス(1353-8と1944-6と命名)は交配され、その子孫(F1)への導入遺伝子の伝達について解析されました。離乳時に解析したところ、1353-8のF1は33匹中3匹、1944-6のF1は46匹中12匹がTg遺伝子を受け継いでおり、伝達率の悪さから2匹とも生殖細胞系列モザイクと思われました。
ここから予想しなかった展開が起こります。驚いたことに、F1のいくつかの新生児は死亡したF0と同様の腹部または腸管出血を起こし、その後死亡しました。親(F0)はどうもなかったのに、F1で表現型が再現されたのです。そこで、これらの生存しているF1を交配し、交配を継続したところ、第2世代(F2)から第4世代(F4)のマウスでトランスジーンを保持していたのは122匹中29匹(1353-8)、子孫は61匹中10匹(1944-6)のみでした。予想された50%の導入比率からの乖離は、導入遺伝子陽性マウスのおよそ2分の1(1353-8)または3分の2(1944-6)が出血して死亡した結果でした。つまり新生児期に出血したF0マウスと同様に、1353-8系統と1944-6系統の子孫マウスの一部は出生時には正常でしたが、分娩後3時間から84時間の間に腹腔または腸管に致命的な出血を起こしていたのです。不思議なことに4日以上生存したTgマウスは出血しませんでしたが、それでも新生児出血の表現型は次世代に受け継がれました。つまり遺伝子を受け継いだマウスの一部だけが出血で生後3日までに死亡し、理由は不明ですが死亡しなかったマウスは生存できたのです。このおかげで系統として樹立することができました。活字だけだと分かりにくいので図3にまとめました。ここからこの研究がどういう展開を辿るかは次回のお楽しみです。なお、今後の予定につきましては別紙にまとめてお知らせしておきます。