肝臓ヒト化マウスの歴史 第5話
株式会社トランスジェニック 顧問 山村研一
いよいよ異種移植
第4話では、urokinase typeのplasminogen activator(uPA)が肝臓で発現するマウス(Alb-uPA)に別のマウスから採取した肝細胞を脾臓に移植して、移植したマウス肝細胞が増殖しマウス肝臓をほぼ占拠できることを紹介しました。これは同種移植でかつ同一系統ですので、移植したマウス肝細胞は拒絶されず、生着することを示しています。次のステップとして、別の種の動物の肝細胞を移植しても生着させることはできるのだろうかという疑問に挑戦する事になりました。これが、第5話の主題で、Rhim et al. Complete reconstitution of mouse liver with xenogeneic hepatocytes. Proc Natl Acad Sci U S A. 1995 May 23;92(11):4942-6.の論文です。すでにお気づきの方もおられると思いますが、第4話で紹介した論文と同じグループによるものです。余談ですが、ここに登場するR. D. Palmiter,とR. L. Brinsterの2人は、トランスジェニックマウス業界では有名で、ことに成長ホルモン遺伝子をメタロチオネイン遺伝子のプロモーターで発現させ、巨大なマウスを作製したことで有名です。興味のある方は原著論文をお読みください(Palmiter at al. Dramatic growth of mice that develop from eggs microinjected with metallothionein-growth hormone fusion genes. Nature. 1982 Dec 16;300(5893):611-5)。更なる余談を書けば、Palmiter博士は分子生物学者で、metallothionein-I遺伝子の転写調節機構を解析していた研究者で、Brinster博士は発生生物学者でマウス胚操作もできる研究者です。単離した遺伝子をマウス受精卵に注入して初めてトランスジェニック(Tg)マウスを作製したのは、J.W. Gordon博士で1980年のことですが、これがきっかけとなり1982年までに多数のTgマウスが作製されました。しかし、遺伝子発現が確認されたのはほとんどありませんでした。そのためTgの技術は使えないのではという疑心暗鬼がで始めた頃に、この巨大マウスの論文が出て、驚くと同時にホッとしたというのが当時の状況です。この論文以前ではほとんどの研究者がヘモグロビン遺伝子を用いてTgを作製していました。ところが、このヘモグロビン遺伝子の発現調節機構が特殊でlocus control regionがないと発現せず、それはプロモーター付近にはないこと、それを含まない遺伝子を使ってTgを作製していたためとのちに分かりました。第4話で出てきた、移植する肝細胞をマーキングするために用いられたMT-lacZ遺伝子は、まさにPalmiter博士の研究から生まれたものだったのです。
さて本題に戻ります。この論文での注目点は4つあります。第1は、異種といってもどの動物が適しているのかということです。第2は、異種細胞を移植した際に生じる拒絶反応を防ぐにはどうすればいいのかです。そして、どういう方法で移植すればいいのかということです。第3は、異種動物の肝細胞をどういう方法でマウス肝細胞と区別し、異種肝細胞の存在を証明するのかです。第4は、異種動物の肝細胞を移植しても肝臓内の肝細胞以外の細胞はマウスです。異種の肝細胞だけを移植して、それが肝臓内に入り、マウス肝細胞に取って代わって小葉構造を構築し、肝機能を果たすことができるのかという疑問です。なお論文には記載されていなくても、理解を助けるために必要な事項も逐次説明を入れておきたいと思います。それでは順番に読み進めていきましょう。
第1の課題:異種動物の選択
まずは異種といってもどの動物が適しているのかということです。この論文では、異種細胞移植の初期研究で、肝臓の増殖と発育の研究に最もよく使われているラットが選択されています。ラットの肝細胞には、ドナー細胞として利点があります。肝臓に存在する種々の細胞集団、例えば肝細胞を明確に分離できるプロトコールが存在することです。これにより増殖した肝細胞が、幹細胞からなのか肝細胞からなのかといった余計な疑問を持たずに実験できます。
第2の課題:拒絶反応の回避と肝臓ラット化マウスの作製
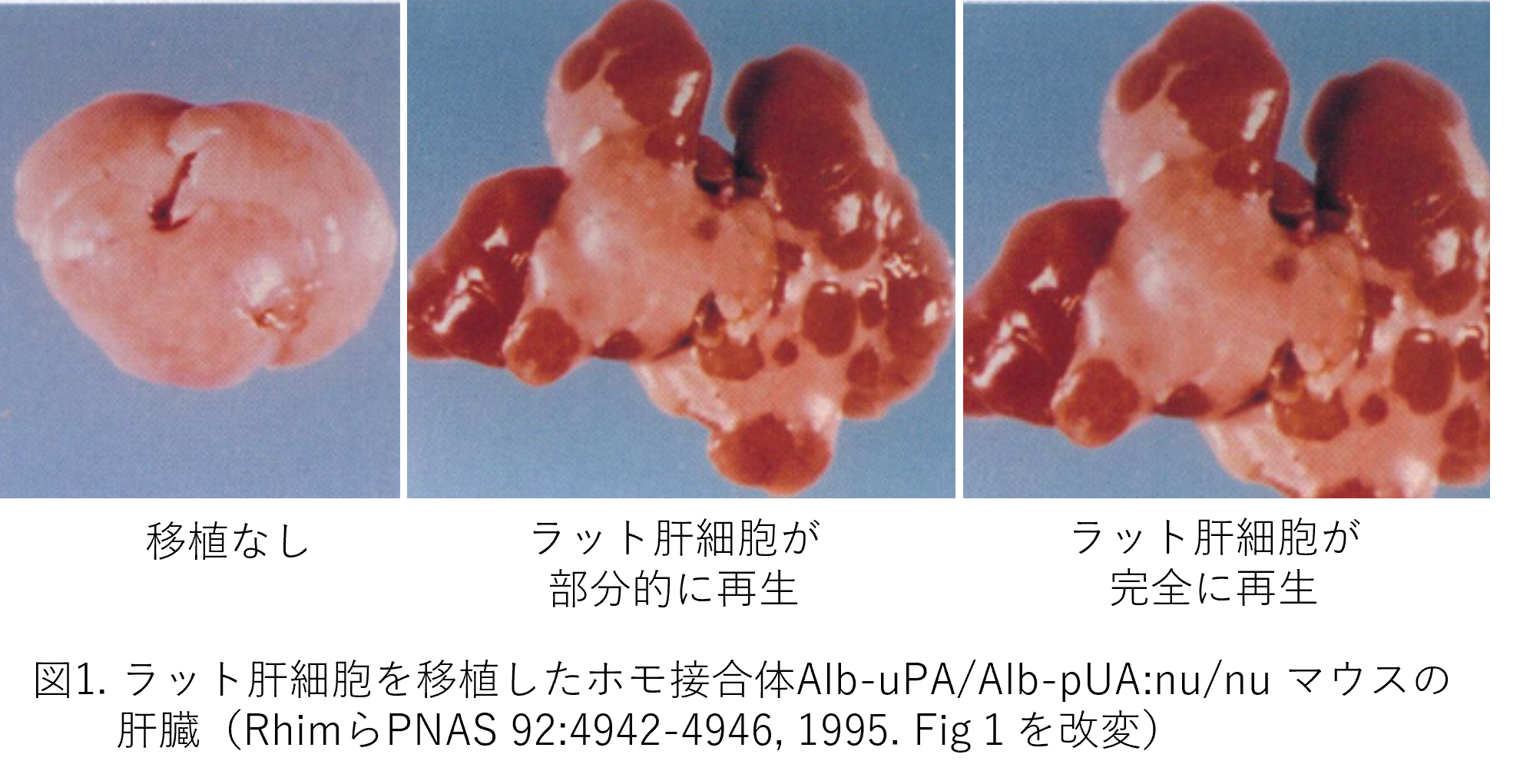
拒絶反応を回避するためには免疫寛容(不全)マウスを使えばいいのではという予測が立てられました。ではどういう免疫寛容マウスを使えばいいのか。論文では、免疫寛容性Alb-uPAトランスジェニック(Tg)マウスを作製するために、Alb-uPA Tgマウスとnudeマウス(nu/nu)を交配しています。Nudeマウスは1962年に無毛(nude)マウスとして発見され、1966年に胸腺がなく、T細胞が出現しないため免疫不全状態にあることが分かったマウスです。Alb-uPAマウスとnu/nuマウスの交配によりレシピエントとなるホモ接合体Alb-uPA/Alb-uPA:nu/nuあるいはヘミ接合体Alb-uPA/+:nu/nuが作製されました。移植方法は、第4話で紹介したマウスからマウスへの移植と大きな違いはありません。移植用のラット肝細胞は3〜6週齢のメスから単離されました。そして、1-2 x 105個のラット肝細胞が、10-15日齢のレシピエントマウスに、脾臓内注射により移植されました。レシピエントマウスは、肝臓の再生がほぼ完了した時点、すなわち肉眼的検査で肝臓のトランスジェニック率が10%以下になった時点で肝臓が解析されたと記載されていますが、外からは肝臓が見れないのにどうやって10%以下を判断したのかは不明です。ただ、次のような記載があります。「Alb-uPAを発現している肝臓は、特徴的な白い肉眼的外観を有しており、コントロールの肝臓と容易に区別できる。ヘミ接合体動物では6週齢から8週齢の間に起こり、ホモ接合体動物では10週齢から14週齢の間にトランスジェニック率が10%以下になった」という記述です。外から見えなくても過去の経験から、ヘミ接合体へ移植した場合は8週齢ごろ、ホモ接合体へ移植した場合は14週齢ごろで解析したと推察できます。もう一つ問題があります。移植したマウスのそれぞれにおける置換率の記載がなく、図1に示しましたように部分的置換とほぼ全置換の例が図として示されているだけです。ここでまた脱線しますが、この論文のように世界初の知見が載った場合は、細かいことは論点とならず骨太のデータだけで掲載されることがよくあります。2報目からは厳しい査定が入ります。これを知る研究者は完璧でなくともいいので早く第1報を投稿することを目指しています。コラム第1話で紹介しましたように、現在、肝臓ヒト化マウス作製にはより重度の免疫不全マウスが用いられています。重度ではない免疫不全マウスに移植してどの程度ラット肝細胞が肝臓のどの程度を置換できるのか興味があるところですが、残念ながら回答は得られませんでした。ともかく図1を見てみましょう。左端は、移植していないホモのレシピエントマウス(Alb-uPA/Alb-uPA:nu/nu)の肝臓が白くなっています。第4話でも出てきた通りです。中央は移植したホモのレシピエントマウスで白い部分と赤い部分からできています。右端は移植したホモのレシピエントマウスでほぼ赤い部分だけから構成されています。これらのことは、赤い部分は移植したマウスだけに観察されており、ラット肝細胞から構成されていると推定できます。いずれにせよラット肝細胞は無事生着しています。
第3の課題:ラット肝細胞の検出
第3の課題は、ラットの肝細胞をどういう方法でマウス肝細胞と区別し、その存在を証明するのかです。3つの方法で検出しています。
第1の方法は、肝臓から抽出したDNAを用いてSouthern blotハイブリダイゼーションを行う方法です。マウスとラットのDNAをPst Iで消化し、マウスphenylethanolamine N-methyltransferase遺伝子のエクソン3に特異的なプローブとハイブリダイゼーションさせると、異なるサイズの制限断片が検出されます。これを利用し特異バンドの濃度の濃さで比率が判定できます。サザンブロットでDNAバンドを定量すると、一部の肝臓サンプルでは最大56%がラット由来であったようです。
第2の方法は、ラットとマウスのキメラ肝臓におけるラット遺伝子の転写産物であるmRNAを検出するために、ラットとマウスの転写産物を区別できるプローブを用いてtransferrin遺伝子の転写産物を分析しています。その結果、ヘミ接合体レシピエントからの再生肝臓サンプルにおいて、ラット由来のtransferrin転写物のパーセンテージは、<1%から92%(n=12)とかなり幅がありました。一方、分析した3匹のホモ接合体動物の再生肝臓サンプルでは、transferrin転写産物の90-100%がラット由来でした(n = 14)。ヘミ接合体でのばらつきの大きさは、Alb-uPAを失って復活した赤色結節(マウス肝細胞)が存在するため、移植したラット肝細胞が競合のため十分増殖できなかったためと考えられます。
なお、DNAの存在比率で見るとラットは最大56%です。一方、転写産物の量でいうと90~100%となっており解離が見られます。これはおかしいと思われるかもしれませんが、次のように説明できます。実は、肝臓は肝細胞だけではなく、胆管上皮細胞、肝類洞内皮細胞、肝星細胞、クッパー細胞等が存在し、肝細胞が占める割合は、体積では80%、細胞数では60%であると言われています(Standring, S. Gray's Anatomy: The Anatomical Basis of Clinical Practice (4th Edition) . Elsevier Health Sciences UK. Kindle 版)。DNA量は細胞数と同じ比率で60%、転写産物でいうとtransferrinは肝細胞でしか発現していませんので100%となります。
第3の方法は、ラットタンパクに対する特異的な抗体と肝臓の組織切片を用いた免疫染色によるラット肝細胞の検出です。2つの抗体を用いており、一つはラット肝細胞を認識するモノクロナール抗体で(図2)、二つ目はラット肝臓タンパク質α2u-グロブリンに対する抗体です(図3)。
図2では、左端に野生型マウスの染色像、中央が野生型ラットで、この抗体ではマウスは染色されず、ラット特異的であることがわかります。右端がAlb-uPA/+:nu/nuにラット肝細胞を移植したもので、ラット肝細胞が増殖した部分(r)と白い結節となっているマウス部分(m)とが観察されます。
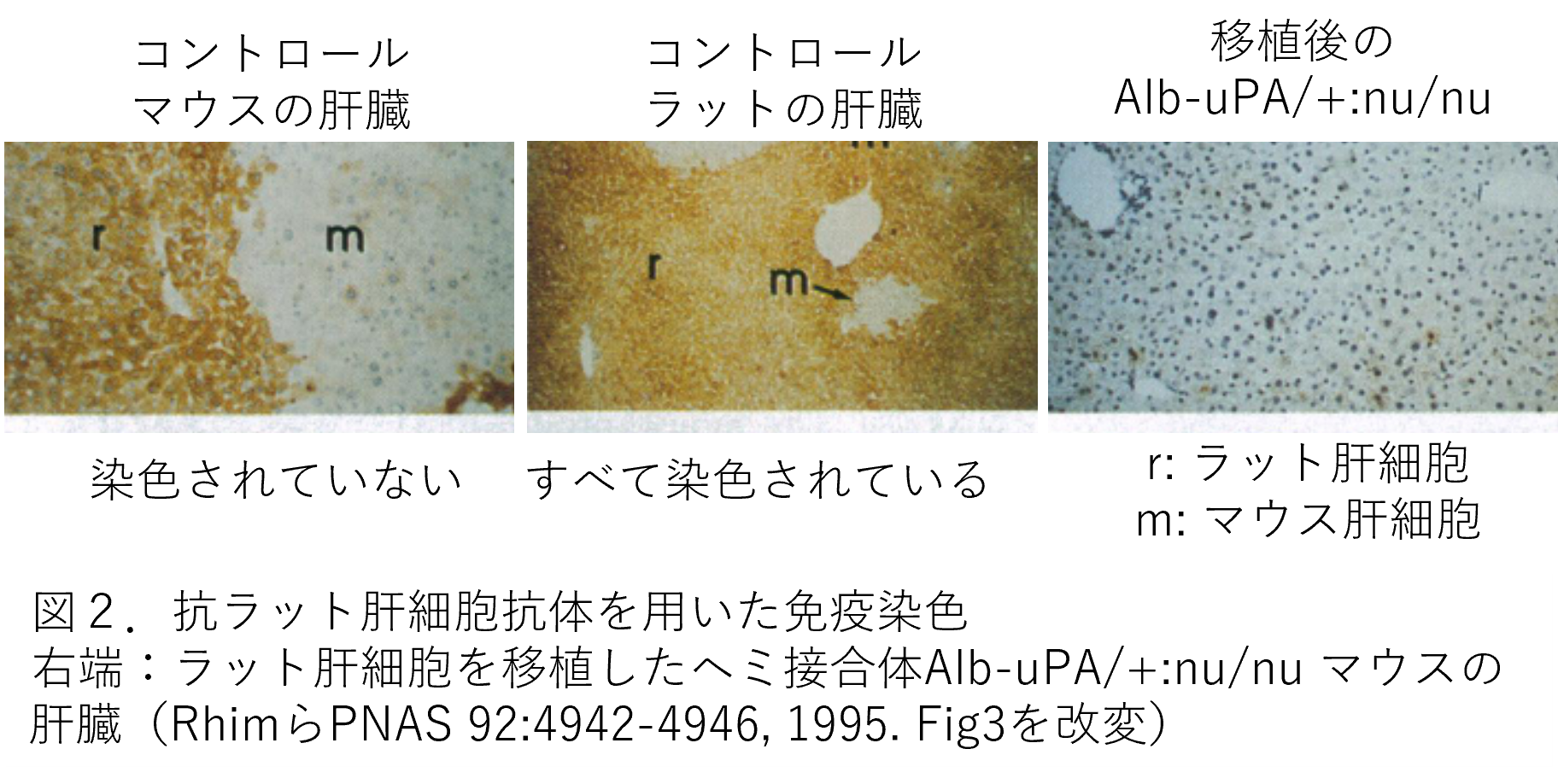
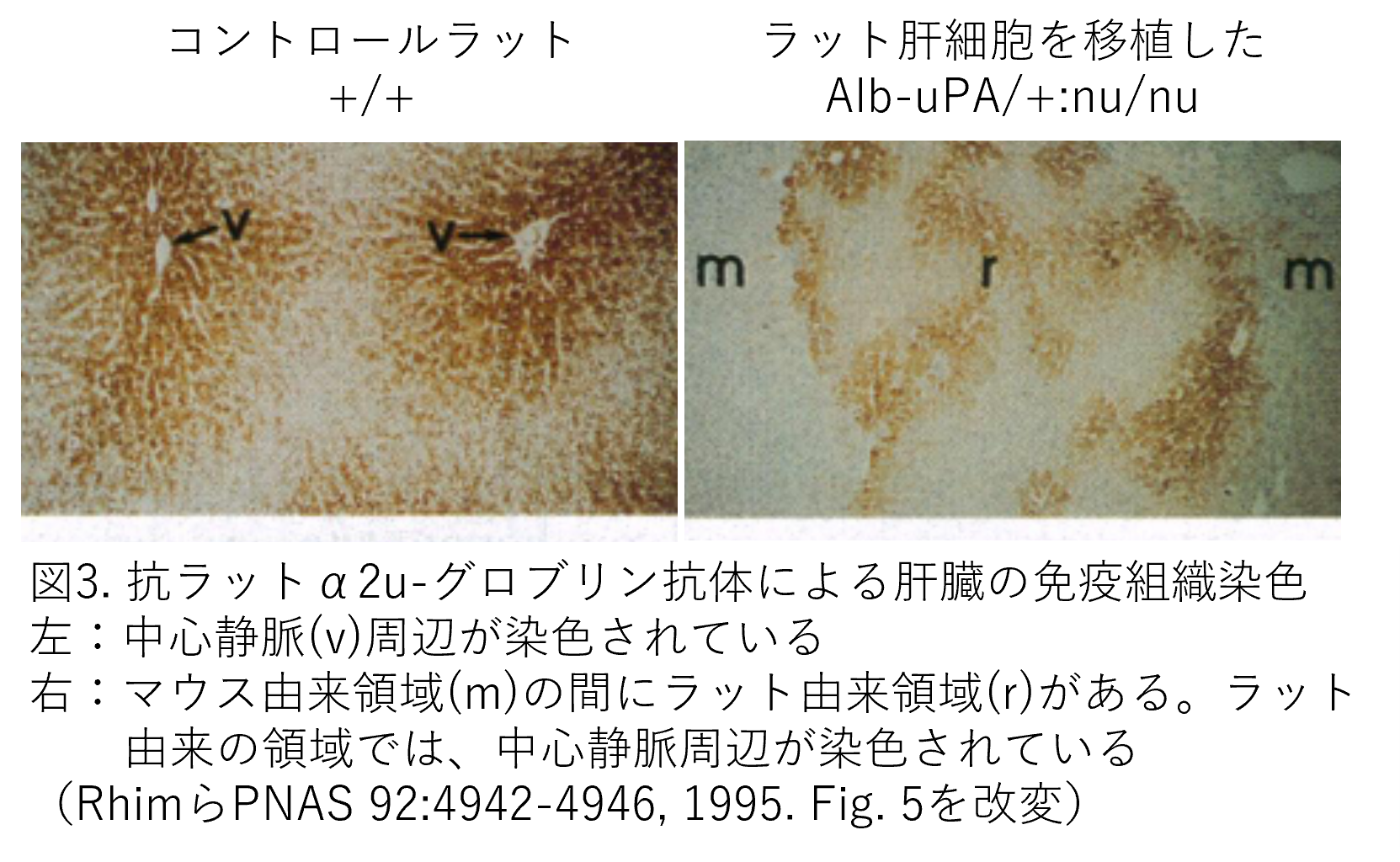
図3では、ラットでは、α2u-グロブリンは肝細胞で合成され、中心静脈周辺の肝細胞内に検出されます(図3左)。一方、ラット-マウスキメラ肝臓では、α2u-グロブリンはラット由来の領域で、正常ラット肝臓と同様のパターンで検出されました(図3右)。
第4の課題:ラット肝細胞はマウス肝臓と協調できるのか
第4の課題は、ラットの肝細胞だけを移植しても肝機能が保たれるのかというものです。本来は詳しいデータが欲しいところですが、Materials and MethodsにもResultsにも記載がありません。しかし、Discussionの中に出てきました。「ホモ接合体動物では、血清総タンパクレベルと血清アルブミンレベルは、マウスのコントロールのレベルと同様であったので、ラット細胞による血清タンパク質の合成は適切に制御されていたことになる。また、動物の臨床的健康状態から、ラット肝細胞はマウスに適したレベルで、中間体代謝や老廃物の解毒といった他の重要な肝細胞機能を果たしており、分泌されたラット肝細胞タンパク質はマウスで機能的であることが示唆された。ラットとマウスのキメラ肝はマウス対照肝と同程度の大きさであったので、ラット肝細胞もマウスの調節的作用に反応した。これらの観察から、ラット肝細胞は、マウスの可溶性因子、細胞外マトリックス、および他のマウス肝細胞上の表面タンパク質と適切に相互作用できる表面タンパク質を産生することが示唆された。」ということで、ラット肝細胞はマウスの複雑な肝臓組織に潜り込んできちんと適応し肝機能を果たしているようです。不思議と言えば不思議です。
いよいよ次は肝臓ヒト化マウス
論文のDiscussionの最後に、「Alb-uPAマウス肝臓をラット肝細胞で再構成できることが示されたことで、ヒト肝細胞でも再構成できる可能性が出てきた。これらのヒト・マウス肝臓は、ヒト肝細胞の保存施設として、あるいはヒト発癌性研究の試薬として、あるいはヒト肝疾患のモデルとして利用できる可能性がある」と記載されています。肝臓ヒト化マウスがすでに念頭にあったわけですが、なぜそれを先にやらなかったのか、最初はそう思いましたがちゃんとした理由があったようです。その答は、次回に書きたいと思いますので、答えを想像しながら「第6話:ヒト肝細胞のTg(Alb-Plau;Rag2-/-)への移植に成功」をお待ちしていただきたいと思います。