肝臓ヒト化マウスの歴史 第20話
株式会社トランスジェニック 顧問 山村研一
小分子化合物を用いたラットES細胞の樹立
今回は、小分子化合物による幹細胞誘導の話のうち、ラットES細胞の樹立とそれを用いた遺伝子改変ラットの作製の話です。小分子化合物による肝細胞の誘導の話はこのシリーズでは初めてで、本来は肝前駆細胞の誘導の論文を紹介する予定でしたが、その前に発表された論文「Kawamata and Ochiya. Generation of genetically modified rats from embryonic stem cells. Proc. Natl, Acad. Sci. USA. 107:14223-14228, 2010」を、コラム第20話番外編1として紹介します。なお、今までとは違うスタイルでコラムを記載することとしました。今までは、本文を読みながら出てきた図や表を見ると理解しやすいと思い、図表を本文中に組み込んでいました。しかし、図が多いと本文とずれが生じ、同じページに表示できず、かえって理解しにくくなることが起こります。であれば、むしろ本文と図表は別々のファイルとし、横に並べて見れるようにしたほうが理解しやすくなると考えました。また、これまでは図表と補足図表を、本文に出てきた順番に並び替え、図表番号も原著とは異なる通し番号をつけ振り分けていましたが、実に大変な作業でしたので、本文と図表を分けるのであれば、省エネのため図表番号も原著論文と同様にして、原著論文と対比できるようにしました。
1.研究目的
実験用ラットは、科学研究のために家畜化された最古の哺乳類であり、150年以上にわたって生理学、毒性学、栄養学、行動学、免疫学、腫瘍学における動物モデルとして用いられています。このような歴史を有するにもかかわらず、ラットは遺伝子機能解析のための遺伝学研究やヒト疾患を反映したノックアウト動物モデルの作出において、マウスに大きく後れを取っています。これは逆遺伝学アプローチに不可欠な生殖系列伝達(germ line transmission)が可能なラットES細胞が存在しないためです。2009年になってようやく、zinc fingerヌクレアーゼを用いた方法により遺伝子破壊ラットが作製されました(Geurts AM, et al. Science 325:433, 2009)。しかし、アルゴリズムに基づく配列特異的DNAヌクレアーゼの作製には特殊な技術が必要であるため、このシステムはほとんどの研究者にとって利用しにくく、使用されていません。したがって、変異マウスと同様に遺伝子標的ラットを日常的に作製するため、ラットES細胞の樹立が望まれていました。我々はキメララットを作製できるラットES細胞を2008年に樹立しましたが、いずれも生殖系列伝達を達成できませんでした。我々の報告直後、他の2つのグループが、いわゆる2i(2つのインヒビター)、MEK (mitogen-activated protein Kinase) inhibitor (PD0325901)とGSK3 (glycogen sunthase kinease-3) inhibitor (CHIR99021)、を用いて生殖系列伝達を伴うラットES細胞の樹立に成功しました(Buehr M, et al. Cell 135:1287-1298, 2008.; Li P, et al. Cell 135:1299-1310, 2008)。その後、2iはマウス、ラット、ヒトにおけるES細胞や誘導多能性幹細胞(iPS細胞)の樹立に広く用いられています。ともかく、MEKとGSK3の阻害は様々な種において多能性の基盤状態を維持すると考えられてきました。2iと併せて、TGF-β1型受容体Alk5阻害剤A-83-01を用いることで、キメラを作製できるラットiPS細胞が樹立されましたが、生殖系列への伝達は達成されていません。さらに、MEK 阻害剤と ALK5 阻害剤の併用により、ヒト線維芽細胞からの iPS 細胞作製効率が劇的に向上しました 。これらの報告は、TGF-βシグナル伝達の阻害も多能性に重要な役割を果たしていることを示しています。
遺伝子改変ラットを作製するには、生殖細胞に安定的に分化できるES細胞の樹立が必須です。そこで第一段階として、Oct4プロモーター/エンハンサーによってVenus(YFP変異体)を発現するOct4-Venusトランスジェニック(Tg)ラットを作製しました。このTg系統を用いることで、ラットES細胞の樹立過程において多能性を有するかどうかをモニタリングすることができます。我々は、20% FBS(fetal bovine serum)を含む培養培地をベースとして、シグナル伝達阻害剤の適切な組み合わせを検討しました。その結果、4 種類の阻害剤、Y-27632、PD0325901、A-83-01および CHIR99021(YPAC と称する)の組み合わせを使用することで、胚盤胞へ注入し生殖キメラが作製できるラットES 細胞の樹立ができましたので報告します。
なお、小分子化合物の利用を理解するためには、ES細胞がどのように樹立され、そして多能性を維持しているのかについて、その発見の歴史をある程度知る必要があります。これは非常に興味深いストーリーですが、今となっては知る人も少なくなっています。マウスES細胞の樹立の論文は1981年に発表されました。私が米国のYale大学でマウスやラットの胚操作を行った研究を終え帰国した1980年の次の年であり、強い興味と衝撃を受けたのを覚えています。ただ、簡単にサラッとかける話でもありませんので、次回のコラム第20話番外編2としてこのことに焦点を当てて紹介したいと思います。
2.方法論
(1)ヒト肝細胞培養
YPAC 培地は、基本培地に 4 種類の阻害剤(10 μM Y-27632(WAKO)、1μM PD0325901(Axon Medchem)、0.5μM A-83-01(TOCRIS)、3μM CHIR99021(Axon Medchem))を添加して調製しました。基本培地は、DMEM(110 mg/L ピルビン酸ナトリウムおよび 200 mM GlutaMAX(GIBCO)を含む)、20% (vol/vol) FBS(ES Cell Qualified FBS、ロット番号 1204059; GIBCO)、0.1 mM 2-メルカプトエタノール(SIGMA)、1% 非必須アミノ酸ストック(GIBCO)、および1×抗生物質・抗真菌剤(GIBCO)で構成されています。feeder細胞としては、ネオマイシ(Millipore)耐性でミトマイシンC処理したMEF(mouse embryonic fibroblast)を用い、1×抗生物質・抗真菌剤添加DMEM/10%(vol/vol)FBS(ロット番号SFB30-1502;EQUITECH-BIO, Inc.)培地で維持しました。動物実験は国立がん研究センター研究所実験動物研究部のガイドラインに準拠して実施しました。本研究ではWistar系統、LEA系統、またはWistar系統とLEA系統の交雑系統を用いました。全てのプライマー配列は表S1(省略)に記載します。
(2)従来法によるOct4-Venusトランスジェニックラットの作製
Oct4プロモーター領域(3.9 kb)のDNA断片を、KOD Version 2 DNAポリメラーゼ(東洋紡)を用いてWistarラットゲノムDNAからPCRで増幅し、pCS2-Venusプラスミドに挿入しました。Oct4プロモーター-Venus(Oct4-Venus)DNA断片をWistar系統ラット(オリエンタルイースト社)の受精卵前核に注入しました。注入した222個の受精卵から6匹のTg個体を得ました。
(3)胚盤胞からのラットES細胞樹立
E4.5またはE5.0に妊娠したラットの子宮から、基本ES培地を用いて胚盤胞を採取しました。酸性タイロード液(アークリソース社)で透明帯を除去後、胚盤胞全体を6ウェルプレートに播種し、YPAC添加有あるいは無の基本ES培地中でMEF上で培養しました。約7日後、胚盤胞の増殖片を小片に切断し、同一YPAC条件下で再播種しました。形成されたES細胞コロニーはAccutaseを用いて分散し、増殖させました。確立したES細胞株はMEF-YPAC条件下で通常維持し、3~4日ごとに継代しました。浮遊コロニーも同様に継代しました。細胞はYPAC培地と凍結保護剤DMSOを用いた標準的手法で凍結保存しました。TgWL1またはTgWL2細胞株では、それぞれ継代4または3までYPAC培地にラットLIF(25)を1,000 U/mL添加し培養しました。
(4)奇形腫形成
免疫不全マウス皮下にTgWW1細胞(継代5、2.6×10⁶個)を注入しました。注入34日後に形成された奇形腫を採取し、パラフィン包埋後H&E染色を行いました。
(5)胚様体形成
ES細胞をAccutaseを用いて単一細胞に分割後、Y-27632を除く3種阻害剤PAC添加/非添加のES基礎培地で低細胞付着性ディッシュ(NUNC)上で培養し、胚様隊形成を行いました。3日目または7日目の胚様体からRNAを抽出し、qPCR解析を行いました。
(6)胚盤胞注入
妊娠4.5日目のラットから採取した胚盤胞を、YPAC(またはPAC)と抗生物質・抗真菌剤不含のES細胞基礎培地からなる500μLの注入用培地に移し、2~3時間培養しました。十分に伸展した胚盤胞をES細胞のマイクロインジェクションに用いました。ES細胞調製のため、10~20個のドーム状または浮遊コロニーを手製カプリラリーで採取し、Accutase滴で5分間処理した後、注入培地の滴中で単一細胞に分離、細胞を500μLの注入培地に移し、室温で30~60分間培養しました。遠心分離後、ES細胞を鉱油(SIGMA)下にある注入培地の液滴に移し、各胚盤胞に10~15個のES細胞を注入、胚の回復を促すため注入培地中で37℃で3~5時間培養しました。その後、10~20個の胚をE3.5期の偽妊娠雌ラットの子宮角に移植しました。キメララットは毛色で判定し、生殖系列伝達は、キメラの交配によるF1ラットの毛色または胎児性腺の生殖細胞におけるOct4-Venus蛍光によって確認しました。動物の遺伝子型判定は、尾部DNAを用いたPCRにより実施しました。
(7)ラットES細胞への遺伝子導入
ヌクレオフェクション法では、SalIで切断したCAG-AmCyan1プラスミド5μgまたはOct4-Venusプラスミド10μgを、それぞれマウスES細胞ヌクレオフェクターキット(Amaxa社)を用いて、TgWW1ラットES細胞3.2×10⁶個またはLL2ラットES細胞3×10⁶個に導入しました。細胞を、2% (vol/vol) マトリゲル (BD Biosciences) を含む YPAC 培地中の MEF 上に播種し、CAG-AmCyan1 を導入した3 つのコロニーまたは Oct4-Venus 導入細胞の 1 つのコロニー(それぞれシアンまたは緑色の蛍光陽性)を手作りのキャピラリーで採取し、薬剤選択なしに増殖させました。
(8)その他の方法
定量PCR解析、ALPおよび免疫蛍光染色については省略します。
3.YPACはOct4-VenusTg胚盤胞の伸長部における多能性を維持
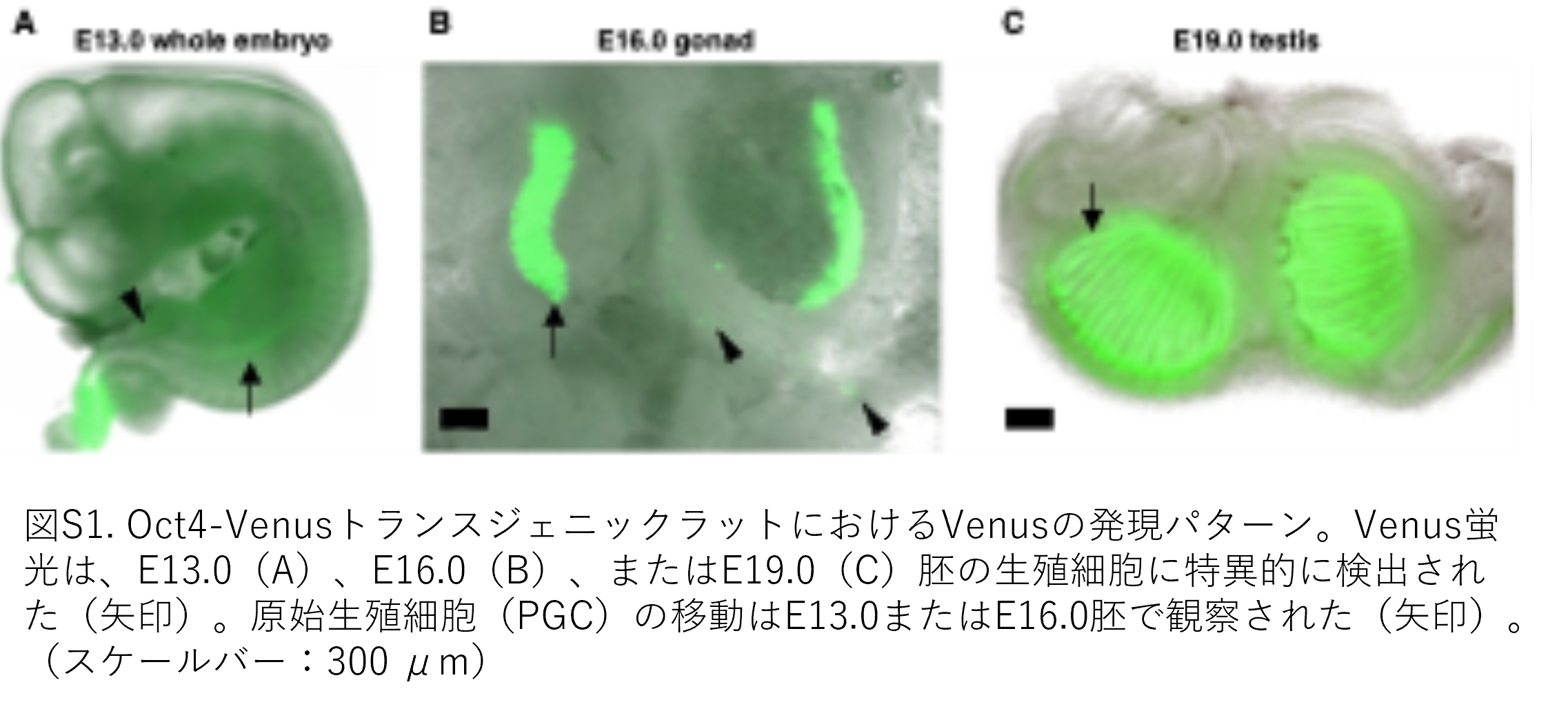
著者らはまず、ラットES細胞の樹立過程における多能性をモニタリングし、キメラ胎児の生殖腺におけるES細胞の生殖細胞分化を解析するため、Oct4-Venus蛍光レポーターを持つTgラットを作製しました。3.9 kbのOct4(別名Pou5f1)プロモーターは近位エンハンサーと遠位エンハンサーの両方を含み、これによりOct4発現は桑実胚、内部細胞塊(inner cell mass: ICM)、上胚葉、原始生殖細胞(primordial germ cell: PGC)、およびES細胞で認められます。Tg胚では、Venusは生殖腺内のPGCに特異的に検出されました(図S1)。この結果は、Oct4-lacZレポータートランスTgマウスを用いた発現解析に関する既報と一致していました。
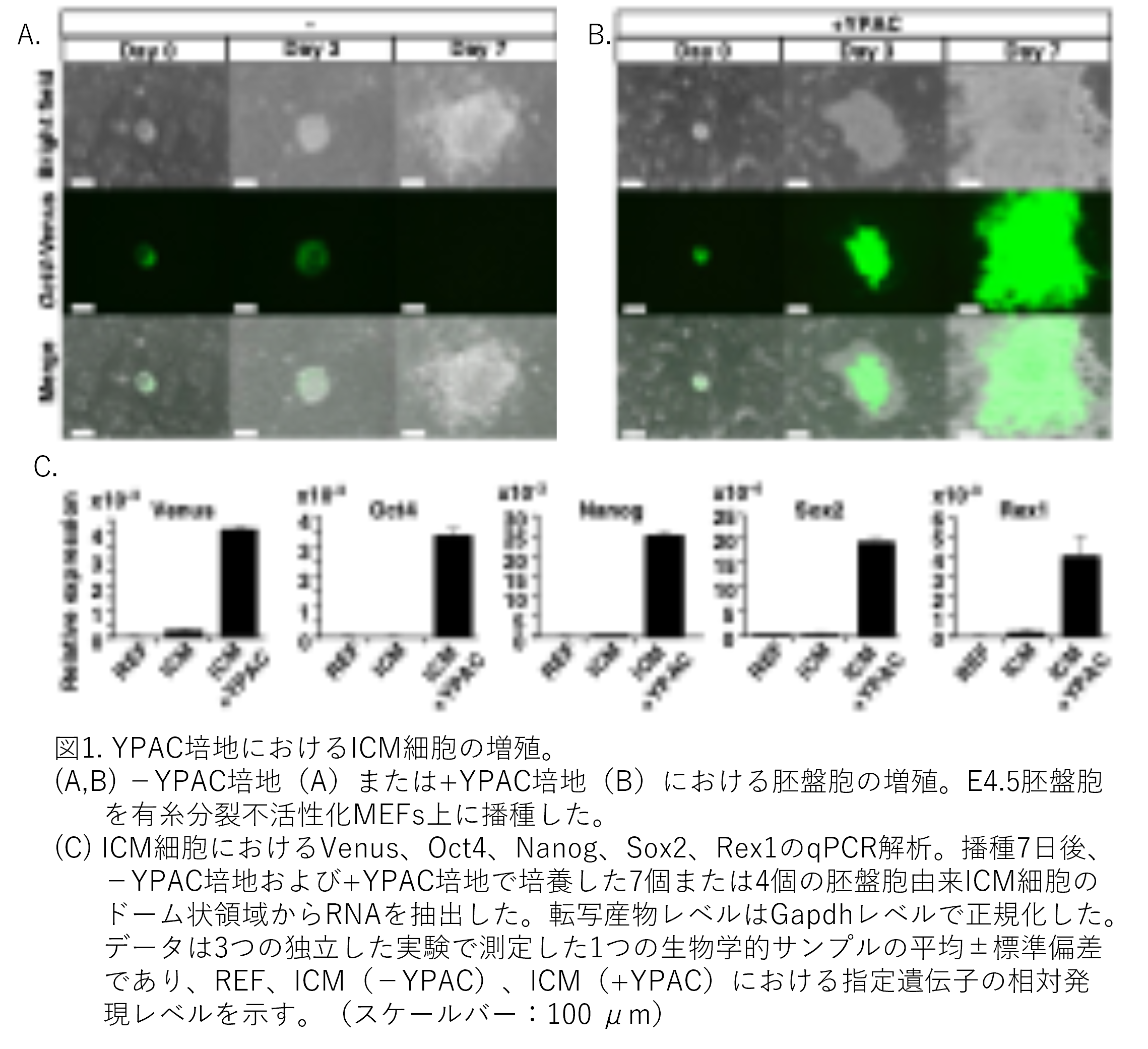
Tg胚盤胞からの増殖は、マウスES細胞を培養する際に一般的に用いられる20% FBS含有基本培地において、YPACの有りまたは無しの元で検討しました。YPAC非添加では、ES様細胞が増殖しマウスES細胞コロニーに類似したドーム状構造を形成したにもかかわらず、播種後3日目にはVenus蛍光が減弱し、7日目には消失しました(図1A)。YPAC存在下では、ICM細胞は7日目においてもVenus蛍光を維持しながら急速に増殖しました(図1B)。YPAC添加ICM細胞におけるES細胞マーカー遺伝子Oct4、Nanog、Sox2、Rex1の発現レベルは、非添加群より 高いことが確認されました(図1C)。YPAC を添加しなかった場合、Oct4 mRNA の減少は Venus mRNA および蛍光の減少と並行していました。YPAC を添加した場合、試験したすべての胚(系統を問わず)の 51 サンプルで胚盤胞の増殖が観察されました(表 1)。胚盤胞は、Tg Wistar (TgWL)と野生型 Wistar の交雑種(TgWW、アルビノ)、野生型 Wistar(WW、アルビノ)、Long-Evans agouti [LEA (LL、アグーチ)]、または Tg Wistar(TgWW) と LEA の交雑種(TgWL、アグーチ)から得ました。この項目では、YPACが存在すると、胚盤胞のICMの増殖が起こり、ES細胞マーカー遺伝子Oct4、Nanog、Sox2、Rex1の発現が高いことを示していますが、項目のタイトルには「多能性を維持」とあるものの、後では出てきますが、ここでは多能性を持っていることを示すデータは出てきません。多能性があるES細胞と同じ遺伝子が発現していることを示したにすぎないと考えます。

4.低分子化合物によるラットES細胞の効率的な樹立と維持
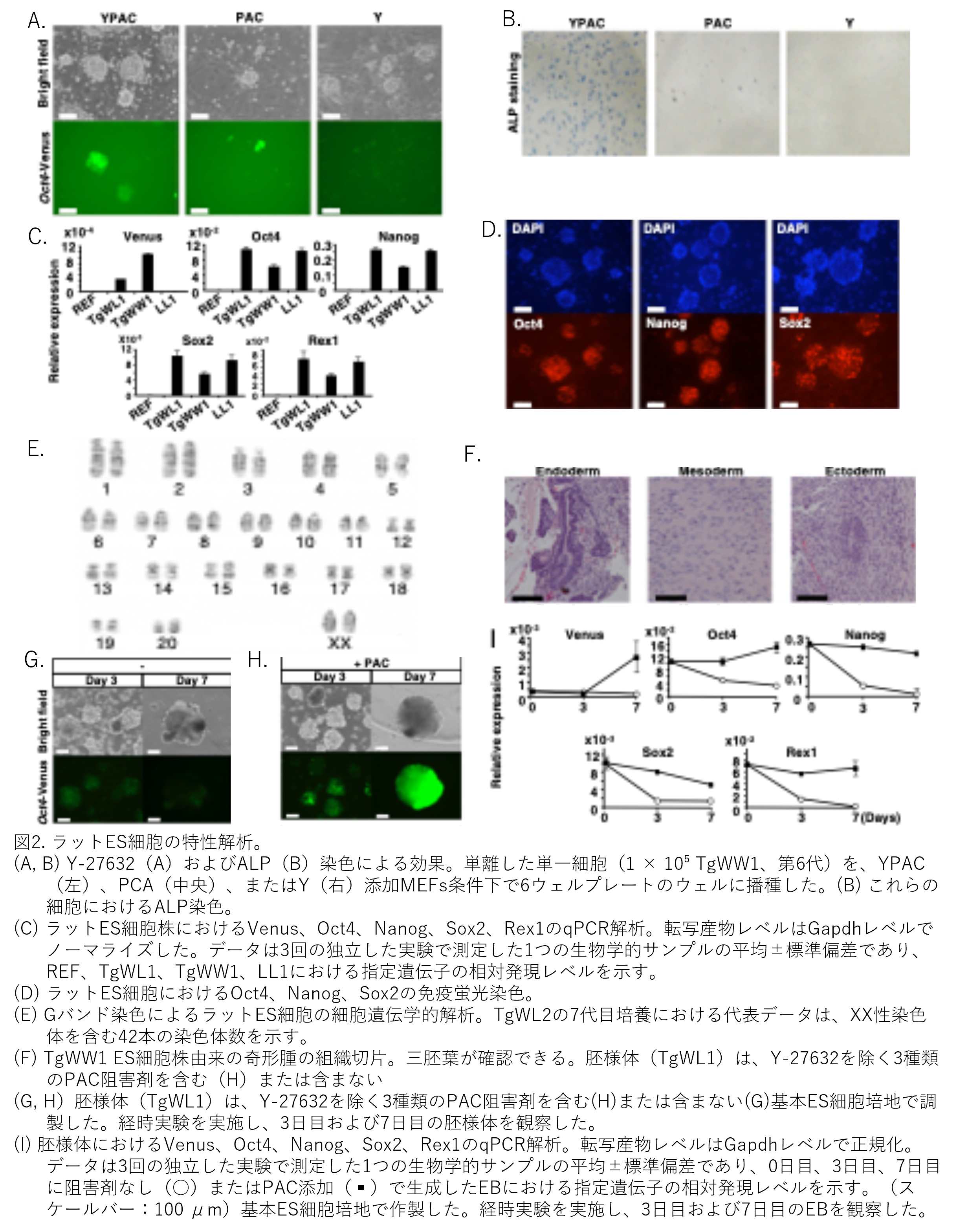
増殖した細胞塊を微小片に分散させ、同一のマウス胚性線維芽細胞(mouse embryonic fibroblast: MEFs)/YPAC培地条件下で再播種しました。未分化コロニーが出現後、Accutase(Innovative Cell Technologies, Inc.)を用いて単一細胞に分離しました。これらの細胞はMEFs上に付着し、ドーム状のコロニーを形成、継続的に継代可能でした(図2A左上)。ほとんどのES細胞(ここでいきなりES細胞という言葉が出現しますが、正確には未分化の増殖細胞としか言えず、まだES細胞と言えないはずで、一つ前の項目で出てきたように「ES様細胞」とすべきと考えます。)は、長期間の継代後もALP活性(図2B左)およびOct4タンパク質発現(図2D左)を示しましたが、Venus蛍光は弱くなったり陰性化しました(図2A左下)。Venus mRNAの発現パターンは、TgWL1とTgWW1細胞株間でOct4の発現パターンと一致しませんでした(図2C)。これらの結果は、ラットES様(原文では「様」はありませんがこちらで勝手に付しました。以下同様とします。)細胞においてOct4-Venusトランスジーンの機能が働かないことを示唆しています(英語を直訳するとこのようになりますが意味不明です。多分、Oct4-Venusの発現パターンはOct4の発現パターンとは一致しないということを意味していると思われます。)。その理由として、長期継代されたラットES様細胞はエピジェネティックなサイレンシング効果を受けている可能性があります。
ES様細胞は、ラット胚性線維芽細胞(rat embryonic fibroblast; REF)と比較して、ES細胞マーカー遺伝子であるOct4、Sox2、Nanog、Rex1のmRNAレベルがより高く維持されていました(図2C)。マイクロアレイ解析でも、ES細胞とREFでは全遺伝子発現が著しく異なる一方、3つのES様細胞株TgWL1、TgWW1、LL1間では類似していることが示されました(図S2は省略)。NanogおよびSox2タンパク質もES様細胞で検出され(図2D)、50細胞の核型をG染色法で解析しました。TgWL1(70%、XX、P14)、TgWL2(84%、XX、P7;図2E)、TgWW1(92%、XX、P5)、LL1(84%、XX、P6)では、ほとんどの細胞が正常な染色体数42を示しました。TgWW1細胞(2.6×10⁶)を免疫不全SCIDマウスの皮下に移植後、34日で奇形腫を形成しました。組織学的検査により、腫瘍には3つの胚葉組織(内胚葉由来の腸管上皮、中胚葉由来の軟骨、外胚葉由来の神経節)が含まれていることが確認されました(図2F)。
Yの効果を確認するため、ラットES様細胞をPAC培地で培養しました。この条件下では、単一細胞のMEFへの接着が失敗したため、まばらなコロニーが形成されましたが、コロニーは未分化形態とALP活性を維持していました(図2A中央およびB中央)。Yのみが、ほとんどの単一細胞をMEFに接着・増殖させることができましたが、それらは分化しており、ALP活性を示しませんでした(図2A右およびB右)。
ES細胞の分化能を解析するための古典的手法は、細胞を浮遊培養させ、胚様体(embryoid body: EB)と呼ばれる三次元凝集体を形成させることです。分散したES様細胞を基礎培地で低細胞接着性ディッシュに播種しました。マウスES細胞と比較して、ES様細胞からのEB形成効率は著しく低くなりました(図2E)。マーカー遺伝子の発現はEB分化過程で低下し(図2I)、PAC存在下では細胞は高効率で凝集、明瞭な3次元構造を形成しました(図2F)。培養7日目のPAC添加EBでは、マーカー遺伝子の高発現が持続していました(図2I)。これらの結果は、PACがES様細胞の多能性維持を可能にする一方、ラットES様細胞がMEFに接着するにはYが必要であることを示唆しています。
5.YPAC注入による生殖キメラの作製
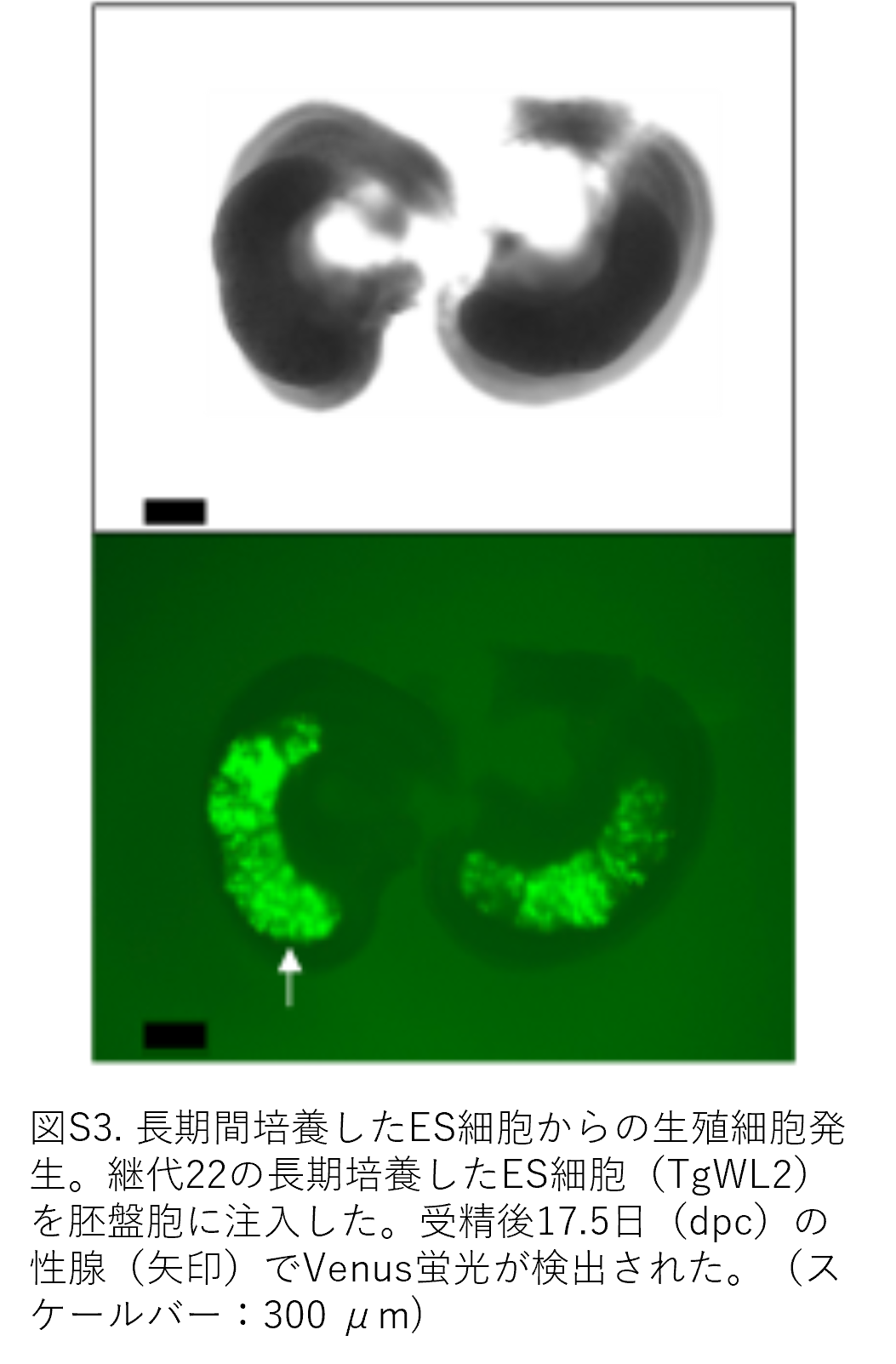
まず、ES様細胞の胚盤胞への注入後における細胞運命や胎児のキメラ状態をモニターするため、CAG-AmCyan1遺伝子を導入し、シアン蛍光を安定して発現するES様細胞を樹立しました(図3A)。阻害剤なしではラットES様細胞は容易に分化するため、キメラ胚を作製する前に、注入および胚盤胞培養過程におけるYPACの効果を調べました(図2A、B、E)。培養5時間後では、YPAC注入のあるなしに関わらず差は認められず、いずれの場合も内部細胞塊(ICM)および栄養外胚葉に複数のシアン陽性細胞が付着している程度でした。しかし培養30時間後には、YPAC非添加群の胚盤胞ではシアン陽性細胞がほとんど存在しませんでしたが、YPAC添加群では複数のシアン陽性細胞がICM表面に検出できました。さらに、YPAC添加により30時間後も胚盤胞形態が維持されていました(図3B)。この結果は、注入過程でのYPAC投与によりES様細胞と受容胚盤胞両方の分化またはアポトーシスが阻害されることを示唆しています。このYPAC注入法により、皮膚および腎臓表面(どういう実験をしたのかの記載がなく、なぜ皮膚と腎臓が出てくるのか不明です)でシアン陽性かつヴィーナス陰性を示すキメラ胚の生存が可能となりました。ヴィーナス陽性細胞は生殖腺に特異的に検出され、ES様細胞が生殖細胞へ分化できることが示唆されました(図3C)。また、他の全ての細胞株においても、胎児生殖腺においてVenus蛍光を検出できましたので、生殖系列キメラが作製できたことを推察できました(表2)。長期培養したTgWL2細胞(22代目)を用いた場合、12胎児中2胎児で生殖腺においてVenus蛍光を検出できました(表2および図S3)。

ES様細胞の多能性を調べるため、胚盤胞への単一細胞注入を行いました。9代目TgWW1細胞を注入後、単一細胞は胚盤胞の内面に付着していました(図3D)。胚発生16.0日(E16.0)の胎児性腺において、Venus蛍光が検出され、生殖細胞への分化が確認(これも単なる推測で、Venusを発現している細胞が存在しているだけです。生殖細胞かどうかは、交配して次世代ラットが生まれてきて初めて言えることです)されました(図3E)。
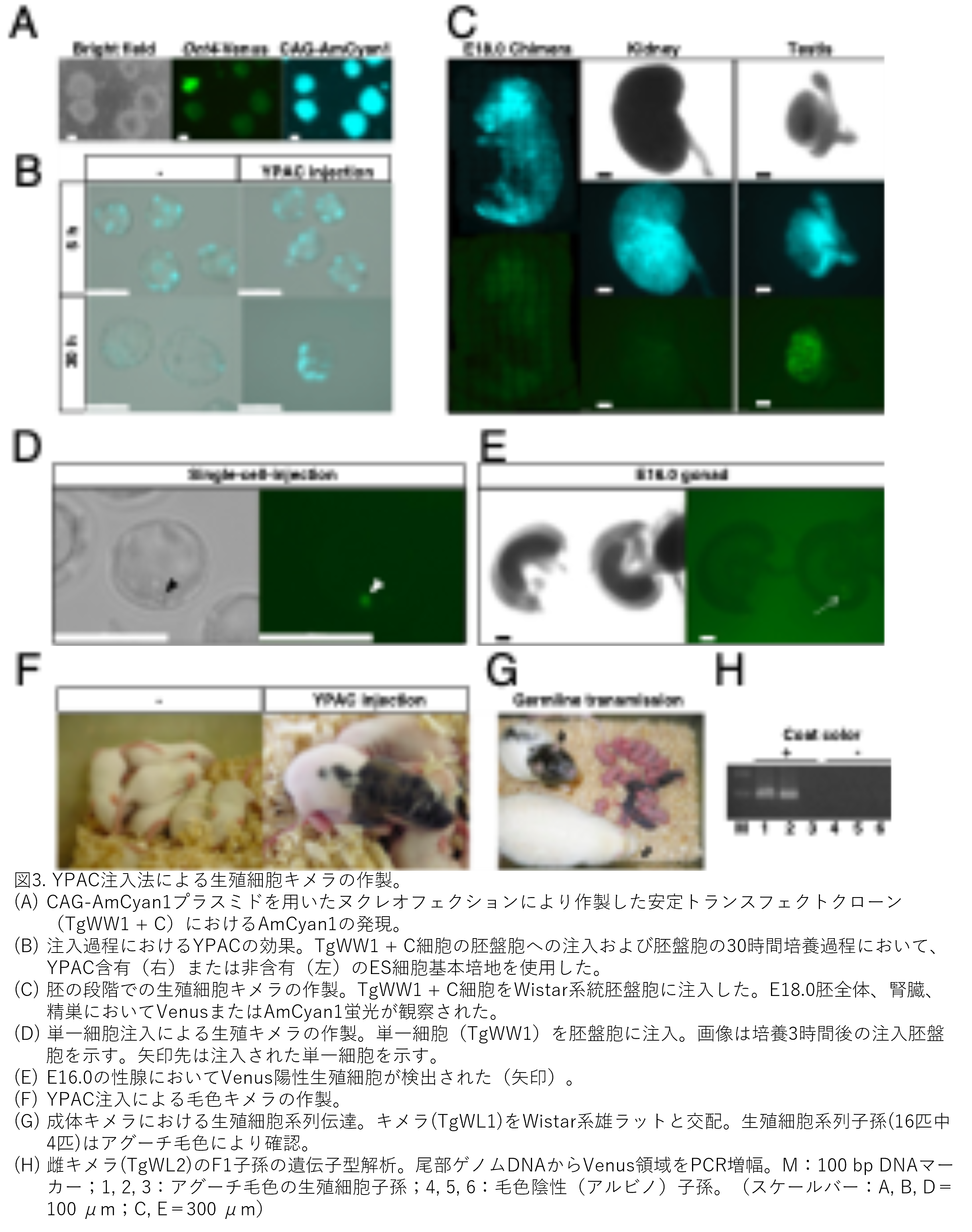
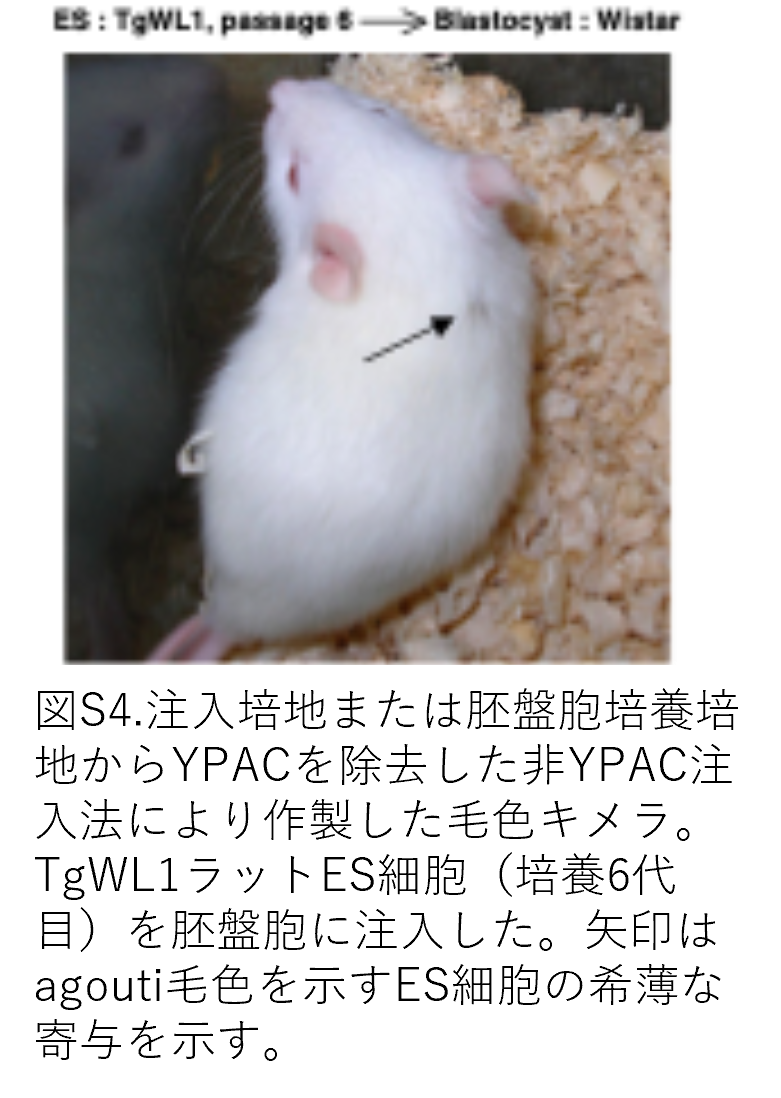
毛色キメラが作製できるかを確認するため、TgWL1細胞をYPAC注入法を用いてWistar胚盤胞に注入しました。TgWL1細胞(継代11または12)から23個のうち8個で毛色キメララットが得られました(図3F右および表3)。YPAC注入法を用いない場合、同じTgWL1細胞を初期継代(6~8代)で使用しても毛色キメラはほとんど作製できませんでした(図3F左および表3)。44匹の子ラットのうち1匹のみ雄キメラでしたが、キメラ率は極めて低いものでした(図S4)。6系統全ての細胞株で毛色キメラの作製に成功しました(表3)。TgWW1またはLL1由来のキメラは図S5に示します。雄ラットとの交配後、6系統全ての成体雌性キメラにおいて、ラット系統には関係なく生殖系列伝達が達成されました(図3Gおよび表3)。遺伝子型解析により、ES様細胞(TgWL2)のOct4-Venusトランスジーンがアグーチ毛色のF1世代生殖細胞子孫へ伝達されたことが示されました(図3H)(ここで初めて「ES様細胞」が真のES細胞ということができます)。

6.ES細胞由来Tgラットの作製
我々は、Venus遺伝子をOct4タンパクと同じ発現パターンを示すラットを作製することを試みました。このため従来のTg(cvTg: conventional Tg)ラットの作製に使用した時と同様に、 Oct4 プロモーター/エンハンサー領域をVenus遺伝子に繋いだOct4-Venus遺伝子をES細胞に導入した後、15個 の Venus 陽性コロニー(LL2 系統)をピックアップしました。2回の継代後、15クローン中13クローンでVenus遺伝子発現のサイレンシングが生じ、Venus陽性クローンの蛍光に明らかな不均一性が認められました(図4A、矢印:画像ではよくわかりません)。一方、均質なVenus蛍光を維持したクローンは2つだけでした(図4B:これもよく分かりません)。発現が安定しているクローンをWistar胚盤胞に注入しキメララットを作製しました。さらに、雌性キメラにおいてOct4-Venusトランスジーンの生殖細胞系列伝達を確認しました(図4C:毛色がはっきりしません、表3)。受精後16.0日(dpc)のオスのesTg胚では生殖腺にVenus蛍光が観察されました(図4D)。esTgラットは明らかな異常はなく成体まで成熟し、正常な生殖能力を有していました。Venus蛍光の発現パターンを確認するため、esTg胚盤胞からES細胞株を樹立しました。増殖過程におけるVenus発現パターン(図4E)は、cvTg胚盤胞(図1B)と同様でしたが、長期継代したesTg細胞(n = 3)ではES細胞内で安定したVenus発現が維持されていました(図4F)。この結果は、Oct4プロモーター/エンハンサー下で正しいVenus発現パターンを有する高品質なesTgラットの作製に成功したことを示しています。


7.要約と考察
我々の結果は、伸長、細胞培養および胚盤胞注入の過程において、血清と細胞シグナル伝達阻害剤の併用を用いることで、極めて高い効率で生殖キメラを作製できることを証明しました。さらに、我々はES細胞から遺伝子改変ラット(esTgラットと命名)を作製し、これらは健康に成長し生殖能力を保持していました。ラットES細胞を用いた本技術の利点は、トランスジーンの正しい発現パターンを有するTg ES細胞クローンを選別できる点です。我々のOct4-Venus esTgラットは、マウスにおける先行研究(9, 18, 19)を踏まえ、多能性モニタリングシステムとしてのiPS細胞作製に有用です。今後の研究では、トランスジーンに対するサイレンシング効果のメカニズム解明が重要となります。
esTgラットの完全な作製は、20%血清とYPACを含む培地を用いることにより、電気刺激による遺伝子導入時の細胞損傷を強力に保護し、クローニングおよび増殖過程を通して安定した核型で多能性を維持している可能性があります。生存率を維持するため、以前の報告ではラットES細胞をエレクトロポレーションし、2i培地で一晩培養する際に一時的に血清が使用されました。本研究でのラットES細胞では、YPAC培地に20%血清が含まれるため遺伝子導入による損傷に耐性があり、こうした対策は不要です。さらに、G418を用いた薬剤選択法が遺伝子改変ラット作製においてラットES細胞で有効であることを確認済みです。
これまでの研究では、過去20年間にわたりラットES細胞の樹立に失敗した原因は血清の存在に起因すると示唆されてきました。実際、血清にはラットES細胞の分化因子だけでなく様々な栄養因子が含まれている可能性があります。我々がこのような重要な多能性細胞株の樹立に成功した理由は、ES細胞を分化から保護するシグナル伝達阻害剤だけでなく、血清中の栄養素にも起因する可能性があります。ES細胞の培養改善には血清品質のモニターが極めて重要です。しかしながら、MEFを培養する際に用いられる血清とは異なる血清の組み合わせにより、ラットES細胞株の安定樹立が可能となりました。したがって、我々の成功は、異なる培養条件下において分化因子に依存せずES細胞を維持できるYPACの強力な潜在能力にも一部起因していると思われます。
注目すべきは、最近の報告では白血病抑制因子(leukemia inhibitory factor: LIF)の添加がラットES細胞またはラットiPS細胞の分化を抑制すると示唆されているにもかかわらず、我々の培養培地ではLIFは必須ではなかったことです。LIF は、フィーダー細胞が分泌し、マウス ES 細胞の自己再生をサポートする重要なサイトカインであることが示されており、LIF はフィーダー細胞を代替することができることが明らかになっています。Yingらは、PD0325901とCHIR99021の併用により、LIF、フィーダー細胞、血清を代替してマウスES細胞の多能性を維持できることを実証しています。これらの報告を考慮すると、血清、MEFs、および2つの阻害剤を含む当培養条件では、LIFの添加は不要であると考えられます。実際、LIFシグナル伝達に関与するTbx3の発現レベルは、ラットES細胞においてアップレギュレートされていました。一方、STAT3の直接的標的遺伝子の一つであるサイトカインシグナル伝達抑制因子3(SOCS3)の発現が、YPAC培地においてもラットLIF刺激後に上昇することが確認されました。したがって、ラットLIFの添加により培養する条件をさらに改善できる可能性があります。
本研究で樹立した6つのES細胞株はいずれも雌でした。この結果はマウスとは一致しません。なぜなら、マウスのES細胞株の大半は雄だからです。我々の研究では、急速な細胞増殖を示すラットES細胞株を継続培養した結果、6つの雌株を樹立できました。したがって、雌性胚盤胞がラットES細胞の樹立に適しているか、あるいは培養液へのMEKおよびGSK3阻害剤の添加がラットES細胞における雌性特異的な急速な細胞増殖を促進すると推測されます。MEKおよびGSK3阻害剤を用いた先行研究でも、7系統中6系統のラットES細胞株が雌性であったと報告されています。
2つの研究グループがラットES細胞の樹立を報告していますが、各グループで数ある細胞株のうち生殖系列伝達を達成したのは1株のみでした(6, 7)。これまでラットES細胞からのノックアウト/ノックインラットの成功例は報告されていません。したがって、より強力な細胞株の作製や、ドナーES細胞・宿主胚盤胞・レシピエント雌動物の最適な系統組み合わせの探索は未解決課題です(6, 7)。本研究では、我々のYPACを用いた培養法と注入法により、ラット系統に依存せず全6系統ES細胞で生殖系列伝達を達成することができました。YPAC条件は、ES細胞からの遺伝子改変ラット作製に適した系統の選択を可能にし、系統特異的疾患モデル研究に大きな利点をもたらすと思われます。我々のラットES細胞とYPAC注入技術の利用により、ノックアウト/ノックインラットの日常的な作製に向けた貴重な基盤が開かれ、これまで報告されていない疾患モデルの作製が期待されます。
次はコラム第20話番外編2です
この論文の内容は問題ないのですが、発生工学のプロから見ると説明が正確ではないと思わされる記述でした。専門誌ならこういうことは起こらないと思いますが、この雑誌は米国科学アカデミーの紀要誌で、アカデミー会員ならば確か1年に5報紹介できます(今もそうであるかは不明です)。その会員名は、論文のタイトル、著者名、所属の下の行に「Communicated by Takashi Sugimura」と記載されていますので、がんセンターの総長であった杉村隆先生であることが分かります。杉村先生は有名ながん研究者です。紹介を依頼された会員は他の研究者にレビューを依頼し、それで問題なければアクセプトとなり公開されます。レビューを依頼した研究者がその分野のプロでなくてもよく、その場合は論文中の言葉遣いが正確ではなくても訂正されず発表されることが起こります。内容に問題なければそれでいいと思いますが、プロの目からするとフラストレーションが溜まります。
それはさておき、一つのテーマ、例えば肝前駆細胞は本当に樹立できるのかといった内容に関して、一つのグループからの報告だけだと、眉唾物の可能性がありますが、異なったグループからの報告が出ると、内容の信憑性は高くなります。それであれば肝前駆細胞は本当にできると言えるようになります。次回は「Katsuda et al. Generation of human hepatic progenitor cells with regenerative and metabolic capacities from primary hepatocytes. Elife 8:e47313, 2019」を紹介しようと考えていましたが、前半で述べたように、小分子化合物の利用を理解するためには、ES細胞がどのように樹立され、そして多能性を維持しているのかについて紹介する必要がありますので、その発見の歴史幹細胞誘導の話を、次回のコラム第20話番外編2としてお届けしたいと思います。その後に「Katsuda et al. Generation of human hepatic progenitor cells with regenerative and metabolic capacities from primary hepatocytes. Elife 8:e47313, 2019」を紹介しようと思います。