肝臓ヒト化マウスの歴史 第6話
株式会社トランスジェニック 顧問 山村研一
ついにヒト肝細胞移植
第5話では、ラット肝臓から採取した肝細胞を免疫寛容(不全)マウスであるAlb-uPA/Alb-uPA:nu/nuあるいはヘミ接合体Alb-uPA/+:nu/nuの脾臓に移植して、移植したマウス肝細胞が増殖しマウス肝臓で生着できることを紹介しました。この論文は1995年に発表されました。今回紹介する論文は、初めての肝臓ヒト化マウスの論文「Dandri et al. Repopulation of mouse liver with human hepatocytes and in vivo infection with Hepatitis B Virus. Hepatology 33 981 988 2001」で2001年に発表されました。1995年の論文では、ヒト肝細胞でも再構成できる可能性が出てきたと記載されており、肝臓ヒト化マウスがすでに念頭にあったわけですが、インパクトの強いその実験をなぜ先にやらなかったのかという疑問を抱きました。その回答をまずお話しします。この論文のMaterial and Methodsに記載されていますが、「小児への移植のためにサイズを縮小した、あるいは外傷性病変のために移植が拒否されたドナーのヒト肝臓、および大腸癌の転移のために部分肝切除(partial hepatectomy: PH)を行った患者から得られた肝組織を、施設のガイドラインに従って細胞単離および移植に使用した。」とあります。つまり、この当時はヒト肝細胞の入手は簡単ではなく、手術時に直接肝臓を入手するしかなく、非常に困難であったということです。今回の論文は、ラットの異種移植の論文から6年も経っていますが、これがその理由です。今では、ヒト肝細胞は市販されており簡単に入手することができます。なおこの市販されているヒト肝細胞を用いて、肝臓ヒト化マウスが作製されたのは2008年(Suemizu et al. BBRC 377:248-252, 2008)のことで、さらに7年かかっています。これは第10話で紹介します。このように研究が行われた当時の状況、つまり当該研究の歴史を知ることも重要で、非常に興味深いと思います。
さて本題です。この論文を発表したグループは、B型肝炎とB型肝炎ウイルス(Hepatitis B virus: HBV)の研究者です。今までの発生生物学や分子生物学とは分野の違う研究者です。余談ですが、HBVは種を超えて感染せず、これを「種特異性」と呼んでいます。ただヒトHBVはチンパンジーにも感染して肝炎を起こします。チンパンジーが使えるにしても飼育やコストを考えると研究が困難なウイルスです。一方、齧歯類の代表として、ウッドチャックのHBVがあり、WHBV(woodchuck hepatitis B virus)と命名されています。ウッドチャックは、体長40-65cm、体重2-6kgとマウスの100倍ぐらいです。サイズは大きいのですがチンパンジーよりは扱いやすいこと、数年で肝硬変から肝細胞癌へと移行します。ヒトのHBV感染では、40年から50年もかかりますので、肝細胞癌の研究にもいい動物モデルです。興味ある方は、(株)特殊免疫研究所の「肝炎ウイルスシリーズ(https://www.tokumen.co.jp/about/csr2/)」の中の「続肝炎ウイルス十話」の第六話をご覧ください(https://www.tokumen.co.jp/wp/column/kanzo2/06.html)。 また、HBVについて簡単に説明しておきます。ウイルス本体は Dane 粒子と呼ばれ、 3,200塩基対の部分的二本鎖環状 DNAウイルスで、DNAポリメラーゼ、逆転写酵素などを包含しており、内部の芯(コア: HBc)と 外被(エンベロープ)の二重構造になっています。エンベロープ蛋白には small S蛋白(HBs)、middle S蛋白(preS2)、 large S(preS1)蛋白の 3 種が存在し、これらがHBs 抗原を構成しています。small S蛋白はウイルスゲノムのS領域から、middle S蛋白は preS2+S領域から、そしてlarge S蛋白は preS1+preS2+S領域からそれぞれ作られます。この論文では、HBs、preS1、HBcの解析結果が記載されています。
この論文の筆者らも1998年にウッドチャックの肝細胞を用いて肝臓ウッドチャック化マウスを作製し論文を発表しています(Peterson et al. Liver repopulation with xenogenic hepatocytes in B and T cell-deficient mice leads to chronic hepadnavirus infection and clonal growth of hepatocellular carcinoma. Proc Natl Acad Sci USA. 1998 Jan 6;95(1):310-5)。実はこの時に、免疫寛容マウスとしてnudeではなく、成熟B細胞とT細胞が欠損するrecombination activation gene 2 (RAG-2)破壊マウス(原著論文ではRAG-2となっていますが、現在の命名法ではRag2ですのでマウス系統としての正しい表記はPlau:Rag2-/-となりますが、Plauは慣用的にuPAが用いられていますのでここではuPA:Rag2-/-を用います)を作製しています。彼らは、移植3か月後には30-90% が置換されたと報告しています。この成果をもとに肝臓ヒト化マウスでもレシピエントとしてuPA:Rag2-/-を用いています。いずれにせよ、この論文の狙いは大きく3つに分けることができます。第1は患者から採取した肝臓から肝細胞を単離する方法、第2は肝臓ヒト化マウスでのヒト肝細胞の置換率、第3はHBVが感染して増殖できるのかです。それでは順番に読み進めていきましょう。
第1の課題:肝臓からの肝細胞の単離
(1)ヒト肝臓の入手方法
まずヒト肝臓の入手ですが2つの種類の肝臓、すなわち(1)ドナー肝臓で、小児への移植のために大人の肝臓の一部を切り取られた肝臓または外傷性病変のためにヒトでの移植に使用できなかったヒト肝臓、と(2)大腸癌が肝臓に転移したために部分肝切除(partial hepatectomy: PH)を受けた患者から得られた肝組織です。これらの肝臓から施設のガイドラインに従って細胞単離およびuPA:Rag2-/-への移植処置を行っています。非常に重要なことですが、あらかじめすべての症例で、患者はHBV、C型肝炎ウイルス、ヒト免疫不全ウイルスの血清マーカーは陰性であり、肝生検はHBVマーカー陰性であることを確認しています。そして単離した肝細胞はPCR法で特異的なHBV-DNA配列がないことも確認しています。ドナーの肝臓は、摘出前に冷たいUniversity of Wisconsin溶液(Du Pont, Wilmington, DE)でその場で灌流し、使用まで氷上に保存しています。腫瘍切除の場合は、切除した肝葉内の転移巣から少なくとも3cmの距離の肝臓を切り取っています。肝動脈と門脈の枝をクランプしてから組織片を切除するまでの時間は、90分から4時間かかっているようです。この時間は肝細胞の生存にとってクリティカルなポイントですが、手術ですからここは自分たちの自由にならないところです。摘出直後、肝組織は氷上に置かれ、切除片の切断面の血管に挿入した複数のカテーテルにより、氷冷したUniversity of Wisconsin溶液で直ちに灌流しています。こういう記述を読むと、手術の際の肝臓の入手がいかに大変であることがわかります。
(2)肝細胞の単離方法
この後、肝臓から1個1個の肝細胞をバラバラにして、バラバラにした肝細胞が生きているかどうかを調べ、そして移植するという手順を踏みます。詳しくご紹介する必要はないかもしれませんが、使用する溶液は結構複雑で先人が苦労して調整したものでもありますし、どんなものか知って欲しいとも思いますので紹介しておきます。まず肝細胞の単離についての記載があります。この論文では、2段階のコラゲナーゼ灌流法を用いて、ヒト肝細胞を単離しています。コラゲナーゼは、コラーゲンをペプチド断片に切断するメタロプロテアーゼです。細胞の剥離や組織からの細胞分散に用いられます。簡単に説明すると、門脈の分枝をカニュレーションし、肝臓または肝臓セグメントを滅菌ガラスプレート上に置き、37℃のウォーターバスに入れ、あらかじめ温めた等張液に半浸漬し、プレ灌流液(Leffert's buffer)で5分還流しています。このLeffert緩衝液の組成は 10 mmol/L HEPES, 3 mmol/L KCl, 130 mmol/L NaCl, 1 mmol/L NaH2PO4-H2O, 10 mmol/L glucose [pH 7.4]) であり、5 mmol/L ethylene glycol-bis(b-aminoethyl ether)-N,N-tetra acetic acid (EGTA)を含んでいます。細胞を扱う時にはpHを一定に保つ必要があり、ここでも使っていますがリン酸緩衝液がよく使われます。ここにHEPESを添加することで、pHを7.2~7.6により安定的に保てるようになります。また、細胞同士の接着にはカルシウムイオン、細胞基質との接着にはマグネシウムイオンが必要ですが、肝細胞同士の接着を剥がすためCa2+キレート剤であるEGTAを用いています。グルコースは細胞を生かしておくためのエネルギー源です。いろんなものが入っていますが、それぞれ理屈があって使用されています。
灌流液の流速は100mL/分であり、すべての溶液はあらかじめ38℃に加温しています。その後、EGTAを含まないLeffert緩衝液を3~5分間肝臓に流し、さらにコラゲナーゼ緩衝液(5 mmol/L CaCl2および0.05% [wt/vol] コラゲナーゼI型[Worthington Biochemical Corp.)で還流しています。コラゲナーゼによる灌流時間は、組織の大きさに応じて10~30分の間で変化させています。その後、すでに消化した肝組織を、5 mmol/L CaCl2を添加した冷Leffert緩衝液に入れ、肝被膜を切断し、細胞を解離させ、100 μmナイロンフィルターでろ過しています。細胞懸濁液を3回遠心し(50g、5分間)、肝細胞と非実質細胞を分離しています。肝細胞の生存率はトリパンブルー染色で判別しています。トリパンブルーは、死細胞では細胞膜を透過し、細胞質を青く染色するため、細胞の生死判定が容易に判定できます。元々トリパンブルーの名前は眠り病を引き起こす寄生虫であるトリパノソーマを殺すことができることに由来しています。こういう一つ一つの小さな積み重ねが重要であることを理解していただきたいと思います。
単離後すぐに、5×105個の生存ヒト肝細胞を50μLのリン酸緩衝生理食塩水に懸濁し、13~21日齢のレシピエントであるuPA:RAG-2-/-マウスに脾臓内注射で移植しています。
第2の課題:肝臓ヒト化マウスでのヒト肝細胞の置換率
(1)移植の成功率
移植した結果、ヒト肝細胞の移植に成功したのは移植用のドナー肝臓(n=3)のみであり、腫瘍切除の周辺組織(n=5)を用いた移植には成功していません。ドナー肝臓から分離された肝細胞の生存率は高く(80%以上)、移植マウスの約80%(12匹中10匹)が生存できました。HSAのレベルは、移植マウスの70%(10匹中7匹)でHSA>1%であった。移植から2ヵ月後、移植に成功した5匹のマウスの血清中のヒトアルブミンレベルは約1%から10%強の間でした(図1)。 これは、移植されたヒト肝細胞がuPA/Rag2-/-の肝臓に生着し、生存していることを強く示唆しています。この論文では、HSAをELISAではなく、ウエスタンブロットでマウスとの量的な比で示しているためややこしい割にあまり正確ではありません。灌流前にかなりの時間(90分から4時間)温熱虚血を行ったPH肝臓からは、生存可能な肝細胞が分離できましたが、細胞生存率は40%から80%と低く、マウスへの移植は成功していません(29匹中0匹)。他の肝臓センターで肝硬変肝や健康なドナーから遊離され、細胞液として当センターに送られてきた肝細胞も移植に成功しませんでした。ということで肝臓から肝細胞の単離までに時間はかかりすぎると肝細胞の質が低下することは明らかでヒト肝細胞の単離には非常に苦労しています。
(2)DNAレベルでのヒト肝細胞の生着の証明
移植した結果、ヒト肝細胞の移植に成功したのは移植用のドナー肝臓(n=3)のみであり、腫瘍切除の周辺組織(n=5)を用いた移植には成功していません。ドナー肝臓から分離された肝細胞の生存率は高く(80%以上)、移植マウスの約80%(12匹中10匹)が生存できました。HSAのレベルは、移植マウスの70%(10匹中7匹)でHSA>1%であった。移植から2ヵ月後、移植に成功した5匹のマウスの血清中のヒトアルブミンレベルは約1%から10%強の間でした(図1)。
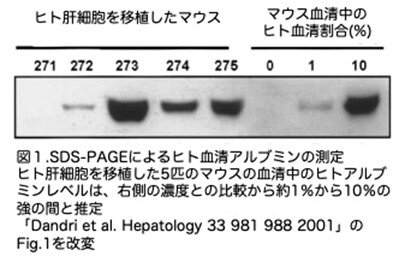
これは、移植されたヒト肝細胞がuPA/Rag2-/-の肝臓に生着し、生存していることを強く示唆しています。この論文では、HSAをELISAではなく、ウエスタンブロットでマウスとの量的な比で示しているためややこしい割にあまり正確ではありません。灌流前にかなりの時間(90分から4時間)温熱虚血を行ったPH肝臓からは、生存可能な肝細胞が分離できましたが、細胞生存率は40%から80%と低く、マウスへの移植は成功していません(29匹中0匹)。他の肝臓センターで肝硬変肝や健康なドナーから遊離され、細胞液として当センターに送られてきた肝細胞も移植に成功しませんでした。ということで肝臓から肝細胞の単離までに時間はかかりすぎると肝細胞の質が低下することは明らかでヒト肝細胞の単離には非常に苦労しています。uPA/Rag2-/-マウスの肝臓へのヒト肝細胞生着を直接的に証明するために、動物は移植の2ヵ月後に、肝臓はPCRとドットブロットハイブリダイゼーションの両方でヒト特異的ゲノム配列の存在について解析しています。まずは、ヒトAlu配列の一部に特異的なプライマーを用いてPCRで増幅し、ヒトまたはヒト肝細胞を移植したuPA:RAG-2-/-マウス肝臓から抽出したDNAを用いて、期待されるサイズの単一バンド(440 bp)が特異的に増幅されることを確認しています。次いで、移植肝に存在するヒト肝細胞の量を大まかに推定するために、マウスの肝臓から抽出したDNAおよびヒトとマウスのゲノムDNAの混合物を、ヒトAlu配列に特異的なDNAプローブとハイブリダイズさせています。PCRおよびドットブロットハイブリダイゼーションのシグナルが陽性であったのは、HSAの存在も陽性であった移植マウス(すなわちマウス#275)の肝臓においてのみでした(図2)。
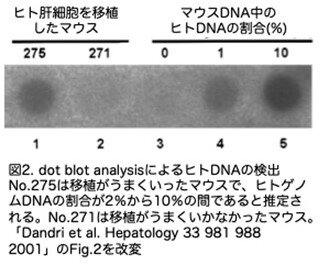
このことから、イムノブロッティングによるヒトアルブミンの検出は、移植効果を推定するのに適したスクリーニングアッセイであることが証明されました。さらに、分析したマウス肝臓標本中のヒトゲノムDNAの割合が2%から10%の間であることと、各動物にヒト肝細胞が5×105個(これはマウス肝臓に存在する肝細胞数の約0.5%)しか移植されていないことと総合して考えると、ある程度の再増殖が起こった可能性を示唆しています。肝臓以外の組織ではヒトDNAは検出されず、正常な成体ヒト肝細胞は脾臓、膵臓、腸間膜、肺では生存していないことが示されています。
第3の課題:HBVが果たして感染して増殖できるのか
(1)血中HBV-DNAの定量
移植2日後にuPA:RAG-2-/-マウス2匹と対照の非移植マウス2匹にHBV感染ヒト血清を注射しました。感染から8週間後、リアルタイム定量PCR法を用いてHBV-DNA量を測定し、HBVウイルス血症を判定しています。uPA:RAG-2-/-マウスの血清には高レベルのHBV DNA(4.5および10×108ゲノム当量/mL血清)が認められましたが、非移植マウスでHBVを注射したマウスではウイルスDNAは検出されませんでした。非移植マウスではHBV-DNAが検出されなかったことから、陽性シグナルは元の注射によるものではないと考えられ、予想通り、ヒト肝細胞を含まないマウスはHBVに感染しにくいことが示されました。
(2)血中のHBV由来タンパクの検出
移植したuPA:RAG-2-/-マウスにHBV感染が成立し増殖していることを示す独立した証拠として、酵素結合免疫吸着測定法(ELISA)と免疫電気泳動法の両方でマウス血清中のウイルスエンベロープタンパク質の存在を分析しています。ELISA法では、マウスの血清の陽性-陰性(signal/noise: S/N)比は74と114であり、これはウイルス血症の高いヒト血清で日常的に得られるシグナルと同じ範囲でした。予想通り、肝細胞移植を受けずにHBV感染血清の投与を受けたマウスの血清では、このアッセイでは陰性でした。Small envelope protein (HBsAg)とlarge S envelope protein (preS1)に対する2種類のモノクロナール抗体(Mabs)を混合した免疫ブロッティング法を用いて、ウイルスエンベロープ蛋白を分析したところ、移植マウスの血清には特異的なバンドが存在しました。これらのバンドは、ブロットに並行してロードした高ウイルス血症ヒト血清(1x1010 HBVゲノム当量/mL血清)由来のHBsおよびpreS1のグリコシル化型および非グリコシル化型と一致していました。補足ですが、グリコシル化は、糖鎖修飾の一つで一般的に細胞外マトリックスでの細胞接着や細胞内のタンパク質-リガンド相互作用をはじめとした多種多様な生物学的プロセスにおいて重要性の高い反応ですが、HBVの場合は感染性に関与すると考えられています。
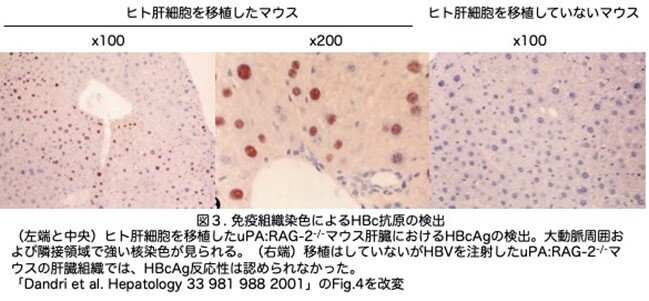
(3)免疫組織学的方法によるHBc抗原 (hepatitis B core antigen )の検出とヒト肝細胞による置換率の推定
HBVはヒト肝細胞にしか感染しませんので、肝臓の組織切片を用いてHBVの抗原を免疫組織学的に染色すればヒト肝細胞でどの程度置換されているか推定できます。ここではHBc抗原を検出しています。ヒト肝細胞を移植したマウスのHBV感染から8週間後、HBc抗原陽性肝細胞はuPA/Rag2-/-マウス肝臓の至る所にクラスターとして認められ、予想通り、門脈周辺や隣接領域に集積していました(図3左端と中央)。移植マウスと感染マウス(レシピエント#222と#226)のそれぞれの複数の凍結切片を観察すると、全肝細胞のそれぞれ5%±2%と15%±4%(平均±SD)にHBcAg陽性染色が認められましたが、非移植マウスでHBVを注射したマウスでは陽性は認められませんでした(図3右端)。 なお、uPAトランスジェニックマウスと交配していないRag2-/-マウスを用いて、ヒト肝細胞を移植後にHBVに感染実験を行いました。しかし、ヒト肝細胞は生着せず、HBV DNAも検出されず、組織化学的にもHBc抗原は陰性でした。
次はHCVを感染する肝臓ヒト化マウス
論文のDiscussionでは、「成体肝臓から分離したヒト肝細胞を移植した場合、血清学的および組織学的値から、これまでに達成された肝臓再増殖の最高度は15%であると推定された。これは、ウッドチャックから分離した肝細胞(最大90%)や他のげっ歯類40から分離した肝細胞を移植した場合の置換レベルを明らかに下回っているが、今回の結果は、部分的な再増殖であっても、多くのHBVキャリアで一般的に見られるウイルス力価と同程度のウイルス力価に達することが可能であることを示している。ヒトの肝細胞を移植して得られた細胞増殖の程度が低いのは、ヒトの肝臓から回収された肝細胞の質が、動物のin vivo灌流によって日常的に得られるものと異なるためと考えられる。さらに、細胞間相互作用や他の機能に関与するヒトとげっ歯類の肝細胞特異的タンパク質の進化の違いも、ヒト肝細胞の再増殖効果を損なう可能性がある。しかし、移植8週間後のHSAとHBVウイルス粒子の産生は、再増殖ヒト肝細胞の機能と分化状態が、成体uPA:Rag2-/-マウスで十分に維持されていることを示している。したがって、このシステムが、C型肝炎ウイルスのような他の肝指向性ウイルスや、許容細胞株が存在しない肝指向性微生物の感染研究にも適しているかどうかを決定することが重要であろう。」と書かれています。そこで次回は「第7話:異種移植のため別の免疫不全マウスSCIDの使用とHCV感染(Mercer et al. Nature Med. 7:927-933, 2001)」をお待ちしていただきたいと思います。