肝臓ヒト化マウスの歴史 第7話
株式会社トランスジェニック 顧問 山村研一
ヒト肝細胞移植2報目
第7話を始める前に第6話での記事の一部訂正をしておきたいと思います。第6話の最初のパラグラフで市販されているヒト肝細胞を用いて、肝臓ヒト化マウスが作製されたのは2008年(Suemizu et al. BBRC 377:248-252, 2008)と紹介しました。しかし、これよりも前の2004年にTateno らがドナーから得た肝細胞と共に市販の凍結された肝細胞を用いて肝臓ヒト化マウの作製に成功していました(Tateno et al. Near Completely Humanized Liver in Mice Shows Human-Type Metabolic Responses to Drugs. Amer. J. Pathol. 165:901-912, 2004)。私の知る限りではこれが最初の報告と思います。これについては次回第8話で紹介します。
第6話では、ヒト肝臓から採取した肝細胞を免疫寛容(不全)マウスであるホモ接合体Alb-uPA/Alb-uPA:Rag2-/-あるいはヘミ接合体Alb-uPA/+:Rag2-/-の脾臓に移植して、移植したマウス肝細胞が増殖しマウス肝臓で生着できること、ヒトでしか感染しないHBVの研究に有用であることを紹介しました。この論文は2001年に発表されました。今回紹介する論文は、2つ目の肝臓ヒト化マウスの論文「Mercer et al. Hepatitis C virus replication in mice with chimeric human livers. Nature Med. 7 927-933, 2001」でこれはC型肝炎ウイルス(HCV)の研究にも有用だという論文です。
いきなり余談で恐縮ですが、この2つの論文は、一方がHBVで他方がHCVとウイルスの違いはありますが、内容はほぼ同じです。発表された雑誌はDandriらの論文がHepatologyで、論文の投稿が November 1, 2000、アクセプトが January 22, 2001、印刷公表がApril, 2001となっています。Mercerらの論文はNature Medicineで、投稿が18 December, 2000、アクセプトが15 June 200、印刷公表はAugust, 2001となっています。数ヶ月の差ですがDandriらの方が投稿、アクセプト、印刷公表いずれも早くなっています。ここであれっと思いました。なぜなら2001年当時のImpact factor (IF)をみると、Hepatologyが「8.096」で、Nature Medicineは「27.906」で、かなりの差があります。普通は早く投稿した方が高いIFの雑誌を狙い、2番手はそれよりIFが低い雑誌に投稿せざるを得ないからです。もっとも投稿したという情報は入らないのかも知れませんが。ただ研究者は常に少しでもいい雑誌、ありていに言えばIFが高い雑誌に、発表したいという要求を持っています。DandriらがなぜNature Medicineに投稿しなかったのか気になるところです。ただ論文としての重要性は雑誌の名前やIFとは関係なく評価はされますので、本当は雑誌のIFをあまり気にする必要はないと思います。IFは雑誌の評価であって、その雑誌に掲載されている個々の論文の評価の物差しではないからです。日本では教員の評価や選考、あるいは研究費の獲得でIFに過剰に影響されるようですので、困ったものです。日本人は、人や物事を自分の判断で正しく評価できないので雑誌の評価に頼るのではないかと思ってしまいます。
さて本題です。この論文を発表したグループは、C型肝炎とC型肝炎ウイルス(Hepatitis C virus: HCV)の研究者です。 Dandriらと同様に今までの発生生物学や分子生物学とは分野の違う研究者です。科学的に見れば、ラットであれヒト肝細胞であれ、異種移植ですから、ラットで成功すればヒトでわざわざやる必要はないと考える人が多いと思います。しかし、やはりヒトの病気と関連した研究を行なっている研究者にとってはヒトでなければ意味がありませんので、ヒトの手術材料から肝細胞を入手するという困難を克服して積極的に研究を行ったことに強い執念を感じます。
HBVと同様にHCVはヒトとチンパンジーにしか感染しません。従って、HBV と同様の研究上の困難さを抱えていました。HCVについて簡単に説明しておきます。HCVは 9,600 塩基からなる一本鎖のプラス(+)鎖RNAウイルスです。肝細胞に感染すると、ゲノムRNAから1つの大きなポリプロテインが翻訳されます。これが、宿主の細胞やウイルスのプロテアーゼによって切断され約10 個のタンパクが産生されます。これらのタンパクはendoplasmic reticulum (ER)膜上に配列し,ER膜が湾入して球状の膜様構造を形成し、ウイルス様の構造となります。その中で(+)鎖RNAから作製されたマイナス (-)鎖RNAを鋳型として(+)鎖RNAが複製されます。複製された(+)鎖RNAはウイルスの構造タンパクに包まれ,ウイルス粒子として細胞外へ放出されます。この論文では、ヒト肝細胞からなる肝臓でHCVが感染し複製しているのかが鍵となります。(+)鎖RNAの検出だけでは感染したウイルスがそこにいるというだけで複製しているという証拠にはなりませんので、(-)鎖RNAが産生されていることを証明する必要があります。この方法がSupplementary informationとして詳しく提供されています。
この第7話では、前回の論文との相違点に注目して紹介したいと思います。
実験材料と方法
まずレシピエントの免疫寛容マウスですが、nudeでもRag2欠損でもなく、SCIDマウスが用いられています。第1話での表1を見てもらうと分かりますが、SCIDではT細胞およびB細胞の欠損に加えてNatural killer T細胞も欠損しており、前回のRag2欠損ではT細胞のB細胞の欠損だけであったのに対し、より免疫不全の状態にあります。
ヒト肝細胞の入手ですが、やはり肝臓の悪性腫瘍の切除の際の肝臓を用いています。肝臓からの肝細胞の単離について細かい記載はなく、基本的にはコラゲナーゼによる灌流を用いています。
ヒト肝細胞の移植は脾臓への注入でこれも標準的な方法です。
血清中のヒトアルブミンは、免疫沈降後のウエスタンブロット法によるもので、現在のようなELISA法ではないようです。
移植したヒト肝細胞の肝臓内での割合を調べるための方法として、肝臓内のヒトDNAの検出や免疫組織化学によるヒト肝細胞の検出もヒト肝細胞に対する特異的な抗体を用いる通常の方法で特記すべきことはありません。
マイナス鎖 RNAの検出は、RT-PCR法とRNase protection assay法で検出しています。RNase protection assay法というのは、(-)鎖と(+)鎖を混ぜると相補的な配列があれば結合して2本鎖になります。ここにRNaseを入れると1本鎖部分は分解しますが、2本鎖部分は分解しません。分解できない2本鎖が検出されることでマイナス鎖RNAが存在することを証明できます。
以下示された結果について要約します。
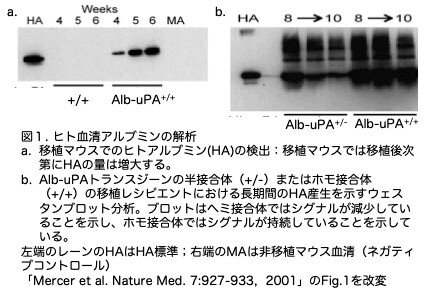
結果1:ヒト移植片の生存率はAlb-uPA接合性と相関する
36匹の移植マウスを対象とした試験的研究では、移植後2週目にヒトアルブミンのバンドが検出され、4-6週目にかけて強度が増加したことから、ヒト肝細胞の増大が示唆されました(図1a)。ヘミ接合体マウスでは当初は強いヒトアルブミンシグナルを示していましたが、次第にシグナルが減弱しました。一方、ホモ接合体マウスでは強いシグナルが継続しました(図1b)。ゲノムDNA解析でも、持続的な高値を示したのはホモ接合体であったのに対し、値が低下したのはヘミ接合体であることが確認されました。このホモとヘミの違いを明確に指摘したのがDandriらと違うところです。
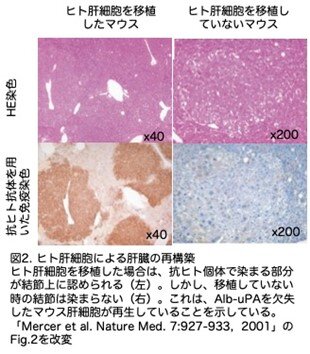
結果2.マウスの肝臓はヒト肝細胞で再構築される
移植されたヒト肝細胞が存在するかどうかをホモ接合体の肝臓の切片を作製し免疫染色で解析しています。典型的な索状構造に配列した肝細胞の大きな結節が抗ヒト抗体で染色されました(図2左)。非移植のホモ接合体マウス肝臓では、結節が見られましたが、ヒト抗体では染色されませんでしたので、これはAlb-uPAを喪失した肝細胞による再生結節と思われます(図2右)。このことから、移植した時に見られる小結節は明らかにヒト由来であり、外側に広がって周囲のマウス由来組織を圧迫していることがわかります。胆道と門脈の構造は、第4話で出てきたRhimらが観察したように、主に宿主由来と思われました。
結果3.移植マウスにおけるHCV感染
この解析がこの論文のハイライトです
(1)移植マウスにおけるHCV感染の確立
ヒト肝細胞の存在の長期化が確認されましたので、次にHCVに感染したヒトの血清をマウスに接種しています。HCVが感染していないことを確認したヒト肝細胞をヘテロ接合体を交配して得た27匹のマウスに移植し、移植後6週目に、血縁関係のないHCV陽性ドナー2人のうち1人(ウイルス遺伝子型1aおよび6a)から得た0.25mlのヒト血清を静脈内および/または腹腔内に投与しました。投与後3週から40週の間に採取した血清サンプルを用いて、逆転写酵素(RT)-PCR法により(+)鎖RNAの存在を分析しています。
野生型コントロール(Alb-uPAを持っていない)の8匹はすべて、HCV RNA陰性でした。ヘミ接合体では、最初は強いヒトアルブミンシグナルを示しましたが、徐々にシグナル強度が減少し、検出期間の中央値(ヒトアルブミンが検出開始からできなくなるまでの期間の中央値)は15.5週間でした。これらのマウスのいずれからも、複数の時点にわたって(+)鎖RNAは検出できませんでした。これとは対照的に、ホモ接合体 4匹はすべて、持続的にヒトアルブミンが検出され(中央値30.5週)、血清のRT-PCR分析により(+)鎖HCV RNAが陽性であることが示されました。定量的HCV RNA分析により、ウイルスレベルは1.4×103〜1.4×106 RNAコピー/mlで、感染ヒト患者と同等の範囲内であることが明らかになりました。両方の遺伝子型(1aと6a)のウイルスとも感染に成功しました。そして感染持続はこの最初の実験では10〜21週間でした。
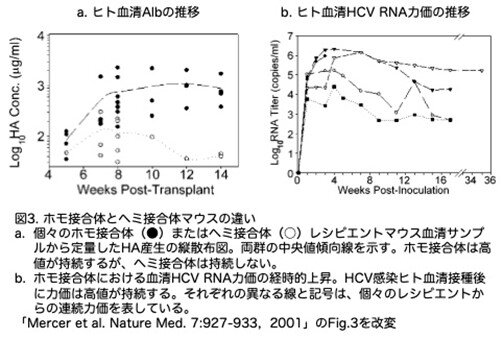
(2)HCV感染はAlb-uPAホモ接合性に依存する
(+)鎖RNAはホモ接合体マウスでは持続的に検出されましたが、ヘミ接合体では検出できていません。著者らは、ヘミ接合体ではヒト肝細胞の喪失が早まると、検出可能なレベルのHCV複製を維持できなくなると仮定しました。ヒトアルブミン産生をより正確に定量化するために、化学発光とリン光イメージングを用いたタンパク質ドットブロットアッセイを開発しました。21匹のレシピエント(ホモ接合体15匹、ヘミ接合体6匹)に、1人のヒトドナーから1×106個の凍結保存ヒト肝細胞を移植した後、無作為に選別したマウスを、定量的ヒトアルブミン分析および/または免疫組織化学的分析に解析しました。
ヘミ接合体マウスとホモ接合体マウスは、最初は同程度のヒトアルブミンシグナル強度を示しましたが、5-6週目には明らかな解離が見られ、10-12週目にはホモ接合体マウスのヒトアルブミンシグナルはヘミ接合体マウスより1桁以上高くなりました(図3a)。
マウス肝臓のヒト肝細胞による置換率を推定するために、肝臓切片をヒト肝細胞に特異的なモノクローナル抗体で免疫染色しました。これらの免疫組織化学的データからホモ接合体マウスでは、ヒト細胞が肝臓断面のかなりの部分(50%以上)を占めていることが分かりました。これとは対照的に、ヘテロ接合体のレシピエントから採取した肝臓の複数の切片を調べたところ、ヒト生着の証拠はごくわずかでした。これらの研究を総合すると、ホモ接合体は、ヘテロ接合体と比較して、ヒト肝細胞生着の程度と期間の両方において極めて有利であることが示されました。
(3)HCV感染の長期持続性
ヒトにおけるウイルス価の持続は、活発な増殖が続いている結果です。しかし、免疫不全のキメラ動物では、HCVの持続性は感染や複製ではなく、ウイルスの排除が遅くなることに起因している可能性があります。この可能性を否定するために、5匹のホモ接合体移植片レシピエントに、250μlの感染ヒト血清(遺伝子型3a;2.95×106ウイルスRNAコピー/ml)が接種されました。したがって、各動物は7.38×105 (2.95x106x0.25) RNAコピーの接種を受けたことになります。3/5のレシピエントで、ウイルス力価は接種後5週間までに、最初の接種量よりそれぞれ16倍、27倍、36倍に増加しました(図3b)。残りの2匹のレシピエントでは、5週間後の力価の増加はわずかでした(それぞれ1.6倍と4.3倍)。最初の力価上昇は、ウイルス複製によると思われ、単にHCVが残存していることによるものではないと考えられました。
(4)レシピエント肝臓における(-)鎖ウイルスRNA
前述しましたようにHCVは、マイナス鎖RNAの中間体を介して複製する(+)鎖RNAウイルスです。肝臓内で(-)鎖HCV RNAが検出されれば、複製が証明できることになります。この複製中間体は(+)鎖の鋳型よりも10-100倍低いレベルで存在すると考えられており、そのため検出はより困難です。
新鮮なヒト血清から5×105コピーのウイルスRNAを接種した9匹のホモ接合体移植片レシピエントでは、接種後3-4週間で(+)鎖HCV RNAを検出できました(図4a、上)。一方、(-)鎖RNAは5/9検体で検出されました(図4a,下、No.1, 3, 5, 6, 9)。さらなる確認のため、著者らの研究室で開発したRNase protection assayを用いて、上記のPCR法で以前に検査した6匹の(-)鎖RNAを測定しています(図4b、No. 1, 4, 5, 6, 8, 9)。その結果は、3匹のマウス(no. 1, 5, 9)で(-)鎖RNAの存在を確認しています。2つの方法によるデータの解離は、RNase protection assayの感度が低いことに起因しているようです。
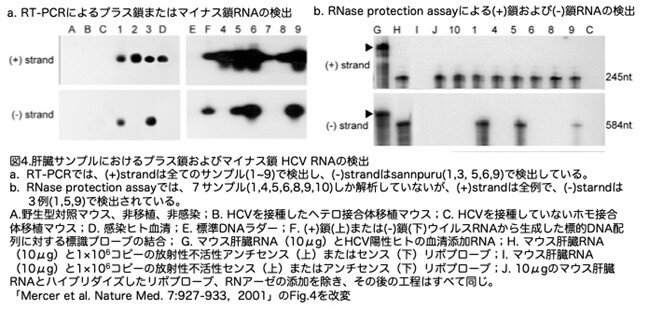
これらの結果から、以下のような議論が展開されています。上記のRT-PCRおよびRNase protection assayによる解析から接種後2〜5週目に採取した肝臓ヒト化マウス肝臓内に(-)鎖HCV RNAが存在することを明確に示しています。定量的RT-PCRによる連続的な週次分析を用いた著者らの以前の実験では、接種後2-4週目にHCV血清力価が急速に上昇することが示され(図3b参照)、これは肝臓内でのウイルス複製速度が最大になる時期と一致します(このコメントがヒトでの結果なのか明確に記述されていません)。いずれにせよこの時期に(-)鎖ウイルスRNAの量も最大になると予想しているようです。この急速な複製期間の後、ウイルスレベルは安定し、複製は明らかに起こっているが、その速度はウイルス消失の速度と同じになる。(-)鎖RNAが感染の初期(2-5週齢)に検出され(図4の接種後3-4週のデータ参照)、後期(12-13週齢)に検出されない(この後期のデータは文章中に出てくるだけで図には示されていません)のは、このためかもしれません。これらのデータを総合すると、このマウスモデルでウイルス複製が活発に行われていることが強く示唆されます。
(5)HCV感染は連続継代が可能である
HCVがヒトからマウス、マウスからマウスへ連続的に継代できるかどうかの解析が行われました。まずヒト患者から採取した新鮮血清(250μl;4.75×105RNAコピー)をヒト肝細胞移植マウスに腹腔内注射しています。接種4週後のウイルス力価は1.76×106コピー/mlでした。この1代目マウスから採取した血清(125μl;約2.19×105RNAコピー)を1回目として別の2代目マウスに腹腔内注射したところ、接種4週後のウイルス力価は1.75×104コピー/mlでした。この2代目マウスの血清を3代目マウスに注射しました(100μl;約1.75×103RNAコピー)。接種後5週間で、ウイルス力価は3.42×106コピー/mlでした。この3代目マウスの血清(20μl)をさらに2匹の4代目マウスに注射したところ、2匹ともその後HCV感染を発症し、接種後9週と11週でそれぞれ1.6×105と4.5×106のウイルス力価を示しました。もしウイルスの複製は起こっていないと仮定すると、4代目マウスは、最初の接種片から約120コピーのウイルスを受け取ったことになります(4.75×105ウイルスコピー×1:8希釈×1:10希釈×1:50希釈=120 RNA、ただしマウス血清量〜1000μlと仮定)。つまりヒトからマウスへの初回接種から24週間後「原文では27週後となっていますが、4週(ヒトから1代目マウス)+4週(1代目から移植した2代目)+5週(2代目から移植した3代目)+11週(3代目から移植した4代目)=24週にしかなりません」、4代目ではヒトの初回接種時の37,500倍(4.5x106/120=37,500)ものウイルスRNAになっていました。このことはヒト→マウス→マウス→マウス→マウスの感染は、感染可能なウイルス粒子の産生と肝細胞内でHCVゲノムの複製を意味しています。
(6)ヒト肝細胞移植マウスにおけるウイルス抗原の発現
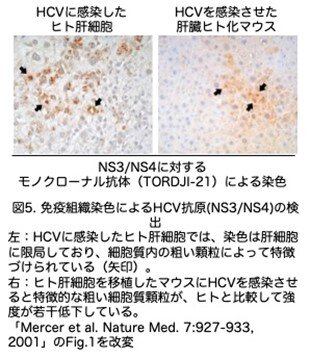
ヒト肝細胞移植マウスの肝臓内のヒト肝細胞におけるHCV蛋白の局在を解析するために、HCV感染ホモ接合体移植マウスから採取した肝臓切片を、ウイルスポリプロテインのNS3/NS4部分に対するモノクローナル抗体で免疫染色しています。コントロールとしたHCVが感染したヒト肝臓の切片では、染色は肝細胞内に限局しており、門脈三つ組(肝小葉の周囲にあるグリソン鞘には、門脈の枝である小葉間静脈、肝動脈の枝である小葉間動脈、胆汁を胆管に送り出す小葉間胆管が並び、この3つは肝3つ組とも呼ばれています)の領域の異常はありませんでした(図5a)。Brodyによって定義された厳密な免疫組織化学的基準を用いると、感染細胞は細胞質内の粗い顆粒によって特徴づけられます(図5a、矢印)。HCVに感染した移植マウスの肝臓から採取した連続切片では、ヒト肝細胞の結節内に局在する特徴的な粗い細胞質顆粒が、ヒトの対照と比較して強度がわずかに低下していることがわかりました(図5b)。HCV抗原はヒト肝細胞でのみ検出され、周囲のマウス由来肝細胞では染色されませんでした。ヒト肝細胞の移植は行ったがHCVに感染させていないホモ接合体マウスの場合、ヒトの細胞は明らかに存在しますが、HCV抗原は検出されませんでした。この免疫組織化学的データは、移植されたAlb-uPAマウスのキメラ肝臓内のヒト肝細胞結節にHCVが感染していることを示す証拠になります。
次は肝臓ヒト化マウスにおける置換率の向上に挑む
前回と今回の論文では、HBVとHCVとウイルスが感染し複製できるだけのヒト肝細胞があればよく、ヒト肝細胞の置換率はあまり問題にはなりませんでした。しかし、目的によっては高度の置換率が求められます。例えば、肝臓は薬物代謝で大きな役割を果たしていますが、動物により薬物の代謝は異なります。したがって、肝臓ヒト化マウスを用いて薬物の安全性の評価を行うためには、ヒト肝細胞による置換率は高度でなければ意味をなしません。これが達成できるかどうか、次回の「Tateno et al. Am. J. Pathol. 165 901-912 2004」をお待ちいただきたいと思います。