肝臓ヒト化マウスの歴史 第9話
株式会社トランスジェニック 顧問 山村研一
肝臓ヒト化マウスにおける置換率の更なる向上に挑む
前回の論文では、ヒト肝細胞による置換率が30%を越えると死亡が多発すること、それが補体による腎臓、膵臓、肺障害によること、補体の活性化をFuthanで阻害することにより移植したマウスの約3割が置換率70%を超えること、そしてこれで薬剤の代謝を検証できるであろうことが示されました。筆者らのグループは、「成長ホルモン(growth hormone: GH)」に着目し、この投与によりさらに置換率を向上させることができるかどうかを検討していますので、その論文(Matsumoto et al. J Endocrinol. 194(3):529-37, 2007)を紹介します。
今回の着目点は5つあります。まず第1は今回の論文は前回の論文と同じ研究グループからの発表ですので、これまでの方法論と比較して何らの違いがあるかどうかです。第2はなぜGHに着目したかということです。第3は、ヒト成長ホルモン(human growth hormone: hGH)の効果を解析するために移植後のヒト肝細胞が直線上に増加する条件を確立したことです。第4は、hGHの効果、つまりヒト肝細胞による置換率が実際向上したかどうかです。第5は、hGH投与によりヒト肝細胞内にシグナルを伝えることができているのかどうかについて、hGHのリセプターの下流にある遺伝子の発現で解析しています。これに付随してこの論文では市販されているヒト肝細胞を2種類(6歳齢と46歳齢のドナーから)を用いていますが、この2種類の肝細胞においてシグナルの伝達に差があるのかどうかが興味のあるところで、それについても言及されています。何しろ市販のヒト肝細胞は5x106個で10万円以上と高いので(レシピエント1匹に1x106移植しますので最大5匹にしか移植できない)、どれを購入するかは重要です。それでは順番に結果を見ていきましょう。
1.方法論の違いはあるのか
この論文でもレシピエントマウスとしてuPA(+/+):PrkdcScid/Scidを用いています。移植には6歳の白人女児(6YG)と46歳の白人男性(46YM)からそれぞれ採取し凍結保存したヒト肝細胞を「In vitro Technologies社(Baltimore, MD, USA)」から購入しています。組換えヒトGH(rhGH;和光純薬工業株式会社、大阪、日本)は水に溶解し、Materials and Methodsには移植後1日目から殺処分日の1日前まで毎日、体重1gあたり2.5μg/10mlのrhGHを皮下注射したと書いてあります。それ以外は特別なことはありません。
2.GHに着目した理由
ラット肝臓の再生能は加齢とともに低下しますが、これは成長ホルモン(GH)およびインスリン様成長因子1(IGF1)の血清濃度が加齢とともに低下するという事実と一致していますので、GHと肝臓再生との関連性が示唆されていました。しかし、ヒト肝細胞の増殖に対するヒトGHの効果は、in vivoでは方法論もなく全く研究されていませんでしたので、検証することになりました。
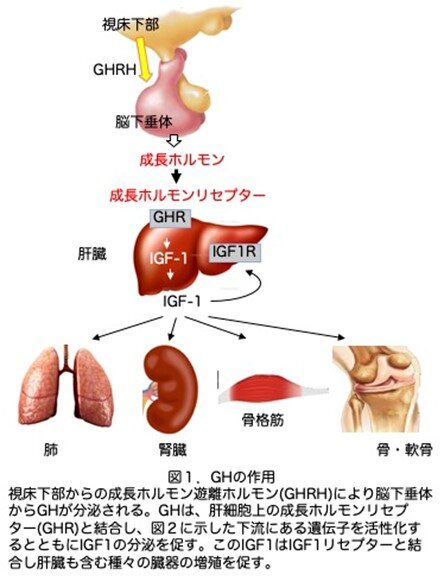
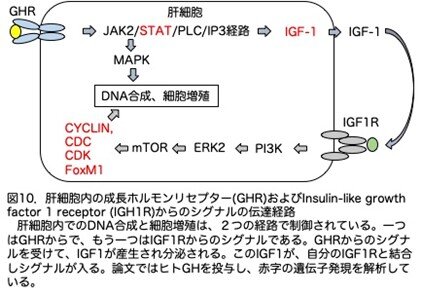
論文には書かれていませんが、GHと成長ホルモンリセプター(GHR)は興味深い分子ですので少し補足しておきます。図1に示しましたが、GHは脳の視床下部からの成長ホルモン遊離ホルモン(GHRH)により脳下垂体のGH産生細胞が刺激され分泌されます。GHは、肝細胞上のGHRと結合し、直接下流にある遺伝子を活性化するとともにIGF1の分泌を促します。このIGF1は肝臓も含む種々の臓器の細胞に発現しているIGF1リセプターと結合し増殖を促します(図1)。このGHとGHRの結合様式が非常に興味深いものです(図2)。GHにはGHRと結合できる部位が2つ、site 1(①)とsite 2 (②)あります。まず、GHのsite 1がGHRと結合し、その後site2にもう一つのGHRが結合し、GHRが2量体化して初めてシグナルを伝達できるようになります(図2a)。GH site1とGH site2はGHRとランダムに結合するのではなく、まずGH site1が先にGHRと結合し、ついでGH site2がGHRと結合し、GHRが2量体化するという順番があるようです。この時GHの量が多いと、一つのGHのsite1にGHRが、もう一つのGHのsite2に別のGHRが結合し、GHRは2量体化できずシグナルを伝えることができなくなります(図2b)。過剰にGHが産生されても受けて側がその異常を察知して逆にGHが拮抗剤のように働きfail safe systemがあるという説明です。ただコラム第5話で、ラットGHを強制発現させると巨大マウスが作製されたことを紹介しました。GHのアミノ酸配列はマウスとラットでほとんど同じなので、この場合は抑制が効いても良さそうで、実際は効いていなようですが理由は不明です。それはさておきこのような結合は、IL-2やIL-3等でもそれらのリセプターとの結合部位は2箇所あり同じような現象が見られるようですが、どれが一番先にこのような調節系を生み出したのか想像すると面白いです。
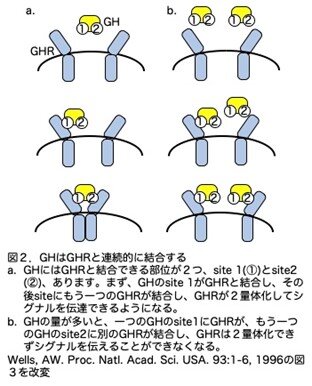
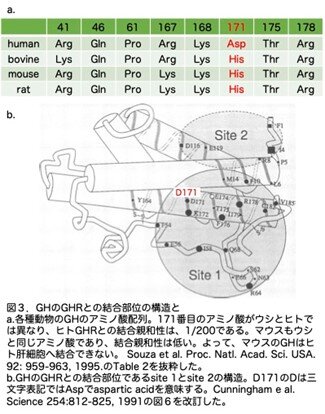
さてマウスにヒト肝細胞を移植するわけですが、マウスGH(mGH)はヒト肝細胞上のGHR(hGHR)の作用できるのかが問題になります。Sousaら(Souza et al. Proc. Natl. Acad. Sci. USA. 92: 959-963, 1995)は、GHの171番目のアミノ酸がウシとヒトでは異なり(図3a)、ウシGHのhGHRとの結合親和性はhGHと比較し1/200であるたことを明らかにしました。この論文ではmGHのhGHRとの結合親和性のデータは示されていませんが、マウスもウシと同じアミノ酸であり、結合親和性は低いと思われます。また、Cunninghamらは(Cunningham et al. Science 254:812-825, 1991)、GHのGHRとの結合部位であるsite 1とsite 2の構造を明らかにし、171番目のアミノ酸(ヒトではアスパラギン酸で一文字表記ではD、三文字表記ではAspです)が、site 1の中にあることを明らかにしています(図3b)。余談ですがこれらのデータから私たちはレシピエントマウスをmGHを破壊しhGHで置換したマウスGhhGH/hGHを用いています。いずれにせよ、これらの事実から、肝臓ヒト化マウスはhGHがin vivoでヒト肝細胞の増殖に及ぼす影響を調べることができると考えられました。
3.hGHの効果を解析するための移植後のヒト肝細胞が直線上に増加する条件の確立
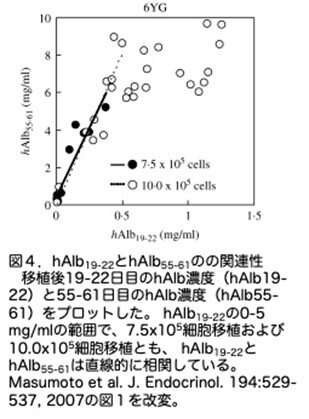
生着したヒト肝細胞の数は、注入した細胞の数に依存し、最終的な(最大)RIに達するまでの時間の長さに関連すると考えられます。そこでまず、再増殖したヒト肝細胞が増殖を終了するまでは、最初に生着したヒト肝細胞数とその後のヒト肝細胞の占有率との間に直線関係が成立するかどうかを調べています。そのため6YG-肝細胞を、10匹のuPA/SCIDマウスには7.5x105個を、27匹のuPA/SCIDマウスには10.0x105個を移植しました。生着したヒト肝細胞数の指標として移植後19-22日目に血中hAlb濃度を測定し、これらをhAlb19-22と名付け、またそれらが増殖したヒト肝細胞数の指標として55-61日目に血中hAlb濃度を測定し、hAlb55-61と名付けています。そして、測定したhAlb19-22のレベルをhAlb55-61のレベルに対してプロットしています(図4)。このグラフを見ると、hAlb19-22とhAlb55-61がほぼ直線的に増加する領域と、hAlb19-22の増加はストップしhAlb55-61の増加がプラトーになる領域の2つの領域からなることがわかりました。プラトーレベル(6-10mg/ml)は、この実験条件におけるhヒト肝細胞の占有率の最大レベル(最大RI)を表していると言えます。要約すると、hAlb19-22<0.5mg/mlからhAlb55-61<6mg/mlの間に、ヒト肝細胞は見かけ上、ほぼ直線的に増加したと結論出来ます。そこで、hAlb19-22 <0.5mg/mlのキメラマウスを用いて、hGHがh肝細胞の増殖に及ぼす影響を調べています。
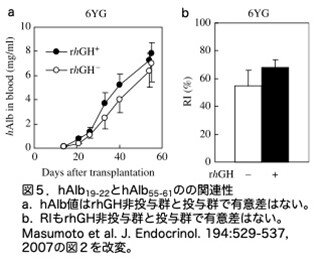
6匹のuPA(+/+):PrkdcScid/Scidマウスに10.0x105 6YG-肝細胞を注入し、その半数に移植後1日目から殺処分日の1日前まで毎日hGHを投与(体重1gあたり2.5μg/10μlのrhGHを皮下注射)、血中hAlb濃度は移植後の実験期間中(55日まで)測定しています。rhGHの非投与群では、移植後55日では、hAlb濃度が8.2±1.1mg/ml、RIは55%程度(数字が示されていない)と増加していましたが(図5a)、予想通りhIGF1は検出できませんでした。一方。rhGH投与群ではhAlb 濃度が7.9±1.9 mg/ml(n=3)でRIは65%程でした(図5b)。非投与群との有意差はありませんでした。しかし hIGFレベルは11.9±11.2 mg/ml (n=3) で予想通り検出されました。つまり、rhG投与群ではhIGF1は検出されたものの、hAlb濃度もRIも非投与群と比較して増加していないと記載されています。この結果は、「Relationship of engraftment with repopulation of h-hepatocytes」という項目の中で記載されており、次の項目「Enhancement of the repopulation of h-hepatocytes by hGH」でもGHの効果を見ていますので、なぜ2回もやるのか混乱します。ともかく次の項目を見てみましょう。
4.hGHの効果はあるのか
7.5x105個の6YG-肝細胞を9匹に移植し(6YG移植群)、そのうち5匹にrhGHを投与しています。また10.0x105個の46YM-肝細胞を8匹に移植し(46YM移植群)、そのうち4匹にrhGHを投与しています。そしてrhGH投与群「rhGH(+)」およびrhGH非投与群「rhGH(-)」、から移植後20日目に血中hAlb が0.01-0.05mg/mlであるマウスをそれぞれ3匹ずつ選択しています。
これらのマウスを用いて、hAlb、置換率(replacement index)、免疫組織学的解析、BrdUを用いたDNA合成の解析を行なっています。
(1)血中hAlbレベル
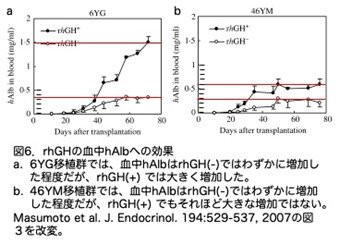
まず、hAlbレベルです。6YG移植群では、 rhGH(-)では移植後20日以降ゆっくりとhAlbは増加しましたが、rhGH(+)では急速に増加しました(図6a)。46YM移植群では、rhGH(-)では6YG移植群と同様にゆっくりとhAlbは増加しましたが、rhGH(+)ではrhGH(-)よりは増加しましたが、6YG移植群のrhGH(+)と比較すると相当低いものでした(図6b)。これは重要なデータですが、グラフだけで示されており、論文には図4でのような定量的な数字のデータは本文中になく、ここでは赤線を引いておよその数的評価ができるようにしています。
(2)置換率
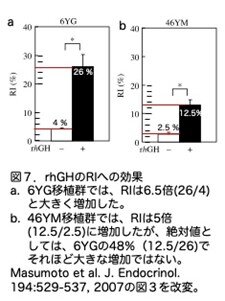
ついで置換率(RI)を解析するために、6YG-および46YM-肝細胞を移植後、70日および76日に殺処分し、6つの肝葉から組織切片を作製し、切片はヒト肝細胞のみを染める抗hCK8/18抗体で染色しています。6YGおよび46YMを移植し、rhGH(-)およびrhGH(+)における免疫陽性細胞の分布を解析しました。ヒト肝細胞のコロニーサイズは、6YG移植群では、rhGH投与でRIは6.5倍(26/4)(論文では6.2倍と表記)と大きく増加しました(図7a)。一方、46YM移植群では、RIは5倍(12.5/2.5)(論文では4.8倍と表記)に増加していますが、絶対値としては、6YGの48%(12.5/26)でそれほど大きな増加ではありませんでした(図7b)。
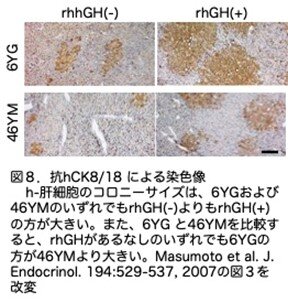
(3)免疫組織学的解析
図8に抗hCK8/18抗体を用いた免疫組織化学的染色像を示します。ヒト肝細胞のコロニーサイズは、6YGおよび46YMのいずれでもrhGH(-)よりもrhGH(+)の方が大きくなりました。また、6YG と46YMを比較すると、rhGHがあるなしのいずれでも6YGの方が46YMより大きいサイズでした。
(4)BrdUを用いたDNA合成
補足ですが、チミジン・アナログであるブロモデオキシウリジン(BrdU)は、細胞周期のS期において新たに合成された DNAに取り込まれます。こうして BrdU が取り込まれた(BrdU でラベルされた)DNA は、抗 BrdU 抗体で検出することができます。したがって、抗 BrdU 抗体は DNA 複製を行う増殖細胞の検出ツールとなり、in vitroのみならずin vivoでの増殖細胞数の計測に応用できます。
rhGHがヒト肝細胞のDNA合成を刺激するかどうかを調べています。6YG-または46YMを移植し、rhGHを注射し、移植後2週間で殺す前にBrdUで曝露しています。BrdU陽性のヒト肝細胞はコロニーの周辺部に多く分布していました(6YG-肝細胞については図9a)。6YG移植では、rhGH投与群のBrdU標識指数はrhGH非投与群のそれよりも2.2倍(11.8/5.2)高く(P<0.05)、GHがヒト肝細胞の細胞周期のS期への進入を誘導したことを示しています(図9b)。46YM移植マウスでは、rhGH投与群の指数はrhGH非投与群の指数より1.4倍(9.7/6.6)でしたが、有意差はありませんでした。
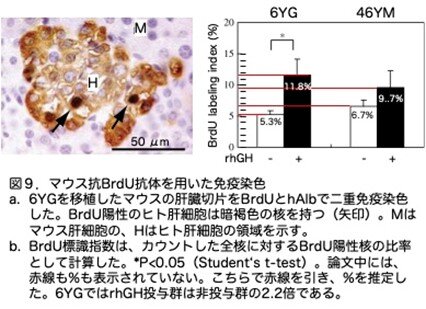
(5)疑問
さてここまで読んでこられた人の中で「はて?」と首を傾げた人もおられるのではないでしょうか。私もその一人です。なぜかと申しますと、図5(論文では図2です)ではrhGHの効果は見られないのに、図6(論文では図3です)では効果ありと記載されているのはどういうことだという疑問です。このことについて論文中では説明がありません。そこで2つの実験を比較してみました(表1)。図5では46YMは使用していませんので、6YGだけを比較してみましょう。そうすると移植した細胞数、rhGHの投与基準であるhAlb値、rhGH投与後のhAlb値が大きく違うことがわかります。つまり、図5では10x105個の6YG細胞を移植し、rhGH投与前のhAlb値が高く、またhrGH投与後のhAlb値が高いことが分かります。つまり、rhGHを投与する前にすでにヒト肝細胞は増殖態勢に入り、その後はrhGHはもはや不要かあるいは効果が見えなくなったように思われます。そこで移植細胞数を減らして再度実験を行ったような気がします。いずれにせよ、GHの効果を期待するには、移植前からrhGHを投与しておくのがいいと考えることもできます。
5.rhGHにより刺激されるシグナル伝達系
では、実際にhGH投与によりヒト肝細胞内にシグナルを伝えることができているのかどうかについて、hGHのリセプターの下流にある遺伝子の発現で解析しています。
まず成長ホルモンによる影響を種々の遺伝子発現で解析していますが、これを理解するためにはGHR以下のシグナル伝達系の予備知識が必要です。肝細胞内でのDNA合成と細胞増殖は、2つの経路で制御されています(図10)。一つはGHRからで、もう一つはIGF1Rからのシグナルです。まずGHRからのシグナルを受けて、これの直接影響下にある伝達系が活性化されます。もう一つはGHRからのシグナルを受けIGF1が産生され分泌されますが、このIGF1が肝細胞上のIGF1Rと結合しシグナルが入ります。これらのシグナル伝達系は非常に複雑なのですが、詳細は省略します。論文ではヒトGHを投与し、赤字の遺伝子発現を解析しています。
6YGまたは46YMを移植後rhGH を投与し、2週間目に肝細胞増殖関連遺伝子の発現を、リアルタイムRT-PCRで解析しています。解析したのは、hGHR、hIGF-1、human signal transducers and activators of transcription (hSTAT) 1、hSTAT3、human forkhead box (hFox) M1、human cell division cycle (hCdc) 25A、h-サイクリンB1、h-サイクリンD1、human cyclin- dependent kinases (hCdk) 1、およびhCdk2です。発現レベルはhGAPDH遺伝子で正規化しています。6YG移植マウス(図11a)と46YM移植マウス(図11b)について、rhGH(+)下での発現とrhGH(-)下での発現の比がグラフに示されています。hIGF1 mRNA の発現は、rhGH(+)では6YG移植マウスでは9.1倍に、46YM移植マウスでは2.6倍に増加させています(P<0.05、Studentのt検定またはWelchの検定)。また、6YG移植マウスでは、rhGHはhSTAT3、hFoxM1、hCdc25Aおよびh-サイクリンD1のmRNAの発現を有意に増加させています(図11a)。一方、46YM移植マウスではどの遺伝子も有意な増加は見られていません(図11b)。
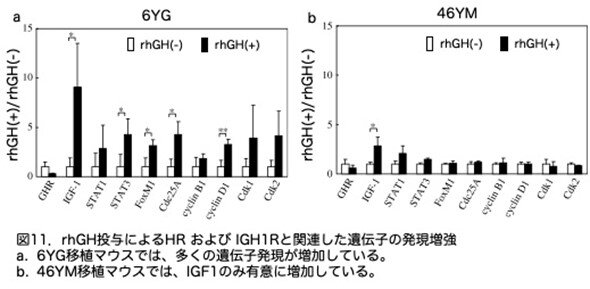
ここで非常に興味ある結果が記載されています。すなわちrhGH(-)群では、6YG移植マウスではhGHR mRNAのレベルが、46YM移植マウスより19.5倍高いレベルで発現していたとのことです。よってこれらの成長関連遺伝子のrhGHに対する反応性の違いは、2つのドナー間のGHR発現レベルの違いに起因している可能性が示唆されたと記載されています。しかし、rhGH(+)/rhGH(-)の比は示されていますが測定値の記載はありませんので確認できませんでした。現在では、ヒト肝細胞を購入する際、可能な限り若い年齢のドナーのものを購入したほうがいいと言われており、この反応性の違いを根拠としていると思われます。
次は新たなレシピエントマウスの開発です
今回の論文では、ヒト肝細胞を移植後にhGHを投与すると、GHRおよびhIGF1-hIGFRのシグナル伝達が活性化され、ヒト肝細胞の増殖亢進、置換率の増加が、血中hAlb値が増加すること、hGHは若いドナーの肝細胞の方がより大きな効果が期待できることが示されました。次回は、新しいレシピエントマウス「Fah-/-:Rag2-/-:Il2rg-/-」(Azuma et al. Robust expansion of human hepatocytes in Fah-/-/Rag2-/-/Il2rg-/- mice. Nat. Biotechnol. 25:903-916, 2007)の論文を紹介したいと思います。