肝臓ヒト化マウスの歴史 第8話
株式会社トランスジェニック 顧問 山村研一
肝臓ヒト化マウスにおける置換率の向上に挑む
前々回と前回の論文では、HBVとHCVとウイルスが感染し複製できることが示されました。しかしこの研究目的ではヒト肝細胞が生着していればよく、ヒト肝細胞の高い置換率は問題にはなりませんでした。しかし、目的によっては高度の置換率が求められます。例えば、肝臓は薬物代謝で大きな役割を果たしていますが、動物により薬物の代謝は異なります。したがって、肝臓ヒト化マウスを用いて薬物の安全性の評価を行うためには、ヒト肝細胞による置換率は高度でなければ意味をなしません。今回のポイントは3つあります。まずヒト肝細胞が高度に再増殖した肝臓を持つuPA/SCIDマウス、つまり高置換率の肝臓ヒト化マウスが作製ができるのかどうかです。ついで、肝臓ヒト化マウスの肝臓について、ヒト肝臓で医薬品の代謝に中心的な役割を果たす様々な型のヒトチトクロームP450(hCYP)の発現が正常であるかどうかです。そして最後が、ヒト肝臓のあるCYPサブタイプに特異的であることが知られている薬物をマウスに投与した際に、キメラ肝臓が適切なhCYPサブタイプの誘導を示すかどうかです。ちょっとその前に余談ですが、論文によって系統名や遺伝子名が異なったりしますので、ここで一度命名規約に基づく表記法について書いておきたいと思います。
命名規約に基づく遺伝子記号や系統名
まずこの研究で用いられているレシピエントの免疫寛容マウスですが、前々回及び前回と同じSCIDマウスが用いられています。SCIDは、Severe Combined Immunodeficientの略称で、このマウスが発見されたのは1983年です(Bosma et al. Nature301:527-530,1983)です。この原因遺伝子はPrkdc (Protein kinase, DNA activated, catalytic polypeptide)遺伝子で、サイズが204kb、エクソンが86個、mRNAのサイズは12,647bp、アミノ酸の数が4128個の大きな遺伝子です。こういう遺伝子で変異を見つけるのは大変だったと思いますが、その変異を明らかにしたのはBluntらで、PNAS 93:10285-10290, 1996に発表しています。exon 85の中のcodon 4046のTAT(tyrosineをコード)の最後がAに変異することで終止コドンであるTAAとなり、C末端が欠けてしまい機能がなくなってしまいます。この論文では場所がcodon 4045と書かれ一つずれていますが、これは間違いではなく、ゲノムデータベースが進歩に応じてよく改定されていますので、1996年当時はそうだったという意味です。ついでに付け加えると、彼らの論文ではこの点変異の説明でなんだか聞きなれない言葉が出てきました。「ochre stop codon」が作り出されたと書かれていました。ちょっと調べてみたのですが当時は、3種類の終止コドンに、それぞれUAG (DNA上はTAG)を「amber」、UGA (DNA上はTGA)を「opal」、及びUAA(DNA上はTAA)を「ochre」という妙な名前がついていましたが、今は使われない用語です。この名前にまつわるストーリーは非常に面白く、「https://lifescience.toyobo.co.jp/page/break/215」に書かれていますので、興味のある方は是非お読みください。これとは別に方法論に名前がついているのがありますが、有名なのは、Southern blottingです。これは開発者であるEdwin Southernの名前に由来しています。ここまでは普通ですが、面白いのはこの後で、RNA blottingをNorthern blottingと、Protein blottingをWestern blottingとしたのはウイットがあるように思います。これについても「https://lifescience.toyobo.co.jp/page/break/216」で紹介されています。
話を元に戻します。SCIDマウスの原因遺伝子はPrkdcですから、この系統は正式には「PrkdcScid/Scid」となります。Scid変異は、すでに紹介した、codon 4046のT→A変異ということになります。一方、このレシピエントはAlbuminプロモターを接続したurokinaseタイプのplasminogen activator遺伝子も持っています。urokinaseタイプのplasminogen activator遺伝子は通称としては「uPA」がよく使われていますが、この正式な遺伝子記号は、plasminogen activator, urokinaseの頭文字をとって「Plau」となります。トランスジェニックマウスの命名は、「 Tg(Alb-Plau)」となります。ただ、これだと記載が大変なのでTgは省略して通称Alb-Plauとしても問題はありません。トランスジーンは、染色体のどこかにランダムに組み込まれ、たまたま内在性遺伝子をヒットすることはありますが、多くは非コード領域に組み込まれ、それに対応する対立遺伝子はありませんので、この場合はヘミ接合体と呼びます。交配によってホモ接合体にできますが、この場合は「Alb-Plau/Alb-Plau」あるいは「Alb-Plau+/+」でいいと思うのですが、ヘミ接合体の表記は命名法にはっきりと記載されていません。したがってここでは便宜的に「Alb-Plau/+」でいいと思います。ここでの「+」は野生型、つまりAlb-Plauがもともとないことを意味します。この場合「Alb-Plau+/-」と書くと、「+」の意味がAlb-Plauがもともとあるかのように錯覚しますし、「-」は野生型を意味するはずなのに、Alb-Plauが変異が入ってノックアウトされたのかのように見え混乱する気がします。この論文中では、ホモマウスを「uPA+/+/SCID+/+」で、ヘミ接合体を「uPA+/-/SCID+/+」で表しています。また、2つの遺伝子が対立遺伝子のときは「/」を用いますが、そうでないときは「/」で分けることはしないで「:」を使います。遺伝学者である私にとっては、この論文に限らずきちんとした命名表記を使ってほしいという思いは強いのですが、今ここで論文での表記と違う使い方をすると混乱しますので、論文の通りの表記で説明します。
高置換率の肝臓ヒト化マウスの作製
ヒト肝細胞の入手ですが、ここでは2つの方法で入手しています。第1は、やはり手術の際に切除した肝臓を用いています。第2は、市販の凍結ヒト肝細胞を用いています。これは、生後9ヵ月の白人男児からの肝細胞(IVT079;In Vitro Technologies Inc.)です。この肝細胞をここでは「9MM」と名付けています。のちに、ドナーの年齢が若いほど置換効率がいいことがわかるのですが、幸運にも若い年齢の肝細胞を用いています。
さて肝臓ヒト化マウスの作製法はルーチンになってきていますので、その方法論は省略し、肝細胞の移植後の結果から書き進めていくことにします。移植実験には3種類のヒト肝細胞を用いています。第1は新鮮肝細胞(37歳と53歳のドナー)、第2は一旦凍結し融解したF-T肝細胞(12歳、47歳、53歳、61歳のドナー)、そして第3は市販の肝細胞(9MM)です。市販の肝細胞凍結した状態のものを購入しそれを融解して移植しますのでF-Tをつけていることもあります。これらの肝細胞から置換率の高い肝細胞を選択するため、uPA+/+:SCID+/+またはuPA+/-:SCID+/+マウスに移植しています。各レシピエントの血中hAb(アルブミン)濃度を定期的に測定し、置換率(replacement index: RI)を推定しています。12歳児の肝細胞(12YM)および9MMの肝細胞は、他の肝細胞よりも高いhAbレベル(2mg/ml)が検出できましたので、以下のすべての移植実験にこの2つが使用されています。F-T 12YM肝細胞を4匹のuPA+/+:SCID+/+マウスに移植したところ、2匹は3mg/mlを超えるhAbの増加は見られず、移植後70日まで生存しました。3匹目のマウスのhAbレベルは移植後34日目に3mg/mlに達しましたが、この時点でマウスは体重が減り始め、最終的には死亡しました。4匹目のマウスのhAbレベルは移植後42日目に3mg/mlに達し、その後 >3mg/ml以上に増加しましたが、hAbレベルは移植後60日目から減少し始め、移植後63日目に死にかけました。これらの結果から、肝臓ヒト化マウスはhAbレベルが3mg/mlを超えると死亡する危険性が高いことが示唆されました。
死亡原因を探るために血中に3mg/mlのhAbが検出されたマウスを調べると、腎臓と膵臓に壊死と萎縮が見られ、またhuman Complement 3 (hC3: ヒト補体3)とhuman membrane attack complex (hMAC)の沈着も観察されました。しかし、肝臓のヒト肝細胞を含む領域には壊死や萎縮は見られませんでした。したがって、ヒト肝細胞が移植されたマウスで観察された細胞死は、ヒト肝細胞から分泌されたhCFsの作用のためであろうと結論しています。
そこでC3やC5を活性化するconvertaseを阻害するFuthanの投与により置換効率が上昇するかを調べています。まずFuthanの投与量を決定しています。詳細は省略しますが、血清hAlb濃度がそれぞれ2〜4mg/ml、4〜6mg/ml、および>6mg/mlの場合、200 μl of 1.5 mg/ml (つまり0.3mg/mouse)の濃度でFuthanの投与をそれぞれ 2日に1回、1日に1回、および1日に2回で実施しました。この投与法で12YMを移植した場合の結果を図1aに示しました。ヒト肝細胞の生着に成功した場合、肝臓ヒト化マウスは3〜13mg/mlの高濃度のhAbを維持しました。また、9MMの移植結果を図1bに示します。これらのマウスのhAbレベルは、実験期間中、移植後80日まで着実に上昇したようです。生着率(何匹中何匹にヒト幹細胞が生着したか)についても結果が示されています。Futhan処理後12YMは、生着率は77%でした。一方、9MMは、生着率は100%でした。しかし、hAlb値を見ると、12YMは6匹中2匹(33%)が5mg/ml以上でしたが、9MMは19匹中3匹(16%)が5mg/ml以上で、確率は低いことが分かりました。
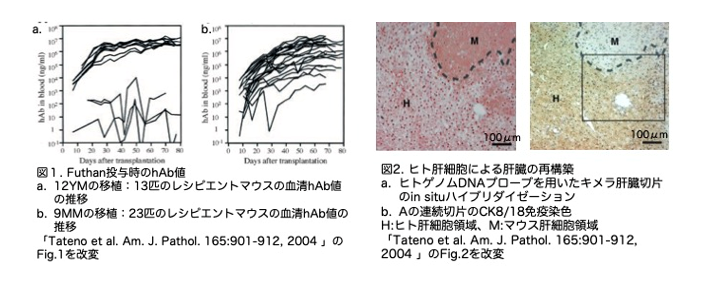
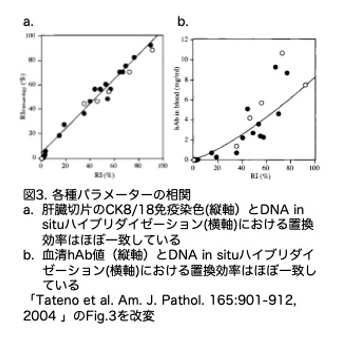
キメラ肝臓中のヒト肝細胞を同定するために、25匹のキメラマウスの連続肝切片を、hDNA in situハイブリダイゼーション(図2a)とhCK8/18免疫染色(図2b)で解析し、それぞれの置換率をRIとRIImmuologyと定義して比較し、両者が非常によく相関することを明らかにしています(図3a)。また、置換率はキメラマウスの血中hAlb濃度ともよく相関していることもわかりました(図3b)。この相関グラフから、血中hAb濃度が5mg/mlのマウスはRI70%であることが示唆されました。したがって、12YMおよび9MMを移植した合算で25(6+19)匹中5 (2+3)匹(20%)がRI70%であると考えられました。
ではどのくらいの速度でヒト肝細胞により置換していくのでしょうか。9MM肝細胞を移植したマウスの肝臓切片を、移植後14日目(A)、35日目(B)、81日目(C)に抗CK8/18抗体で染色したところ、この時点でのRIImmunology値はそれぞれ10、33、92%であった記載されています(図4)。個体ごとに置換率は違うはずなので、本来は解析した数と平均値と誤差が表示されるはずですがそれの記述はありません。しかもこのデータは、本文中ではなく、Figure 4の説明文中のみの記載となっています。いずれにせよ、およそ移植後81日目には75%以上の置換率に達するものと思われます。これは初めて示された貴重なデータです。

ヒト血清注射対照マウスの溶血、CF、GPTレベルおよびキメラマウスのCFレベルに対するFuthanの効果も解析しています。前述したようにFuthanはヒト補体阻害剤であることから、補体に関連した溶血を防止できるかを検討しています。マウスにヒト血清を投与した場合に、hCFs、溶血、GTPのレベルが上昇するかどうか、また、マウスにFuthanを併用投与した場合に、これらのパラメータのレベルの上昇が抑制されるかどうかを調べています。ヒト血清をuPA-/-:SCID+/+マウスに30 ml/kg体重で腹腔内注射しました。血液中のhC3aとhAbの濃度は、注射の3時間後と9時間後に、それぞれ145ng/mlと5mg/mlでピークに達しています。溶血は波長414nmでの吸光度で測定し注射から3時間後にプラトーに達し、その段階での濃度はコントロール値の3.4倍でした。赤血球が破壊されるとGPTが漏出しますが注射後9時間で17倍に増加しました。ヒト血清注射の2時間後にFuthanを投与すると、溶血は0.373±0.083から0.202±0.111へ、hC3aは80±33から29±22へ、GPTのレベルは154.5±106.2から58.3±48.1へと統計学的に有意に減少しました。
hAb 3 mg/mlの肝臓ヒト化マウスの血中hC3a濃度は60〜200 ng/mlで、ヒト血清を注射したコントロールマウスの溶血レベルおよびGPTから判断して、組織に損傷を誘発するのに十分な高濃度であると推定されました。またhAb血中濃度が2mg/mlの肝臓ヒト化マウスにおいてFuthanがhC3a濃度を実際に低下させるかどうかを検討しています。肝臓ヒト化マウスにFuthanを腹腔内投与し、1時間後にhC3aを測定したところ、hC3aレベルはFuthan注射後は75.9±15.2%(n=7)まで減少させることがわかりました(注射前のレベルが記載されておらず、下がったかどうか判断できていません)。したがって、Futhanがヒト補体の活性化を阻害し、ヒト肝細胞の障害を防げることが分かりました。
肝臓ヒト化マウスにおけるhCyp遺伝子の発現
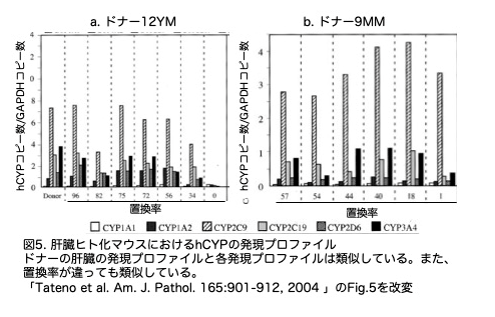
2つ目の課題は肝臓ヒト化マウスに肝臓でヒトCyp遺伝子が発現し正常パターンであるかどうかです。論文では肝臓の抽出液を用いてウエスタンブロットを行いタンパクレベルでhCYP2C9の発現を確認しています(結果は省略)。また、RNAレベルの発現はhCYP1A1, 1A2, 2C9, 2C19, 2D6, 3A4の6種類についてそれらのmRNAを、total RNAサンプルを用いた定量的逆転写酵素PCR法で定量しています。コントロールの uPA-/-:SCID+/+ マウス肝臓では hCYP 配列は増幅されなかったことから、使用したプライマーはヒト遺伝子に特異的であることが示されました。hCYP の相対コピー数は、観察されたコピー数を hGAPDH のコピー数に対して正規化することで求めています。解析の結果、mRNA量は hCYP ごとに異なり、ドナー肝臓の 6 つの hCYP 遺伝子を発現強度に基づいて便宜的に3 群に分けることができました:1) hCYP1A1 を含む低発現群、2) hCYP1A2, 2C19, 2D6, 3A4 を含む中発現群、3) hCYP2C9 を含む高発現群です。解析の結果、各肝臓ヒト化マウスの hCYP 発現プロファイルはドナーの 12YM(図 5a) よび9MM(図 5b)と相関していました。各肝臓ヒト化マウスごとにRIは違いますが発現プロファイルは類似していました。以上から、肝臓ヒト化マウスにおけるCYPの発現プロファイルは、正常ヒト肝臓を再現できていると思われます。
薬物投与時のhCYPサブタイプの誘導
肝臓ヒト化マウスがCYP誘導化学物質に反応できるかどうかも調べられました。原文では専門ではない人にとっては記述が足りないところがありますので、補足しつつ解説します。リファンピシンはCYP3A4を特異的に誘導することが知られています。一方、3-methylcholanthrene (3-MC)はCYP1A1およびCYP1A2を特異的に誘導します。まずリファンピシンを12YMの肝細胞を持つヒト化マウスに投与し、肝組織中の 6 種類の hCYP の mRNA 量を 24 時間後に測定しました。投与前のhCYP3A4 の平均相対コピー数は1.9±1.3(n=6) であったのに対し、リファンピシン投与後は11.0±1.3(n=3)と5.8倍と有意に上昇しました(P<0.001) (図6a)。このレベルの誘導は、試験した 6 種類の hCYP の中で hCYP3A4 に特異的でした。
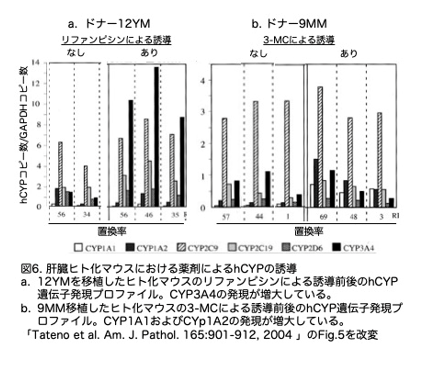
9MMの肝細胞を持つヒト化マウスへの3-MC投与前の平均相対コピー数は、hCYP1A1は0.057±0.018、CYP1A2は0.15±0.07(n=6)でしたが、3-MCの投与後はhCYP1A1は0.57±0.02 (n =3)と10倍へと有意(p<0.001)に増加、そしてCYP1A2も0.96±0.49 (n=3)と6.4倍へと有意(P<0.05)に増加しました(図6b)。なお、uPA-/-:SCID+/+ マウスでは、リファンピシンも 3-MC も 6 種類の hCYP の発現を誘導しませんでしたので、使用したプライマーはヒトの配列に特異的であることが示されました。つまりマウスのCyp遺伝子の発現を拾っているのではないことを意味します。なお論文では誘導しないマウスのデータは6匹ずつ表示されていますが(図5参照)、その中から誘導に用いたマウスの置換率に近いマウスを抜粋しています。個々の移植ごとに置換率は異なりますので、同じ置換率のマウスを揃えるのは不可能です。
次は肝臓ヒト化マウスにおける置換率の向上に挑む
今回の論文では、ヒト肝細胞による置換率が30%を越えると死亡が多発すること、それが補体による腎臓、膵臓、肺障害によること、補体の活性化をFuthanで阻害することにより12YMを移植したマウスの約3割(2/6)が置換率70%を超えること、そしてこれで薬剤の代謝を検証できるであろうことが示されました。また、市販の肝細胞を用いても置換率のばらつきが大きいものの肝臓ヒト化マウスを作製できることが示されました。これらは肝臓ヒト化マウスのヒト疾患や薬物代謝研究への応用において大きな進歩といえます。ただ、置換率70%で十分かどうか、また置換率70%のマウスの割合が低いということから、ちょっと足りないなというのが正直な感想ですので、さらなら努力が求められるところです。次回は、その努力の一つとして同じグループから発表されたヒト肝細胞の増殖を促す効果のある成長ホルモン遺伝子の効果の程を明らかにした論文「Matsumoto et al. J Endocrinol. 194(3):529-37, 2007」を紹介したいと思います。