肝臓ヒト化マウスの歴史 第13話 番外編1
株式会社トランスジェニック 顧問 山村研一
ピロリジジンアルカロイド(Pyrrolizidine alkaloid: PA)の活用
前回のコラムでは、HSV-TKを利用した肝臓ヒト化マウス作製の論文「Hasegawa et al. BBRC 405:405-410, 2011」を紹介しました。当初今回は、ピロリジジンアルカロイド(pyrrolizidine alkaloid: PA)の一種であるレトロルシン(retrorsine)を活用し効率良く肝臓ヒト化マウスを作製する方法の論文「Michailidis et al. Proc Natl Acad Sci USA. 117:1678-1688, 2020」を紹介しようと考えました。しかし、PAに関してこの論文にはあまり記述がありませんでした。その理由はこれに先立つ論文が2つあり、それらの論文に記述されているためでした。この2つの論文はマウスではなくラットを用いた実験です。1つ目は、1995年に発表された論文「Laconi et al. Carcinogenesis 16:139-142, 1995)」で、2つ目は1998年に発表された論文「Laconi et al. Am. J. Pathol. 153 :319 -329, 1998」です。いずれも同じグループからの論文で、ラット肝細胞をラットに移植する同種移植実験が記載されています。Michailidisらの論文に先行すること25年前と22年前に発表されています。PAを用いた研究としてはプライオリティーを有する研究ですので、紹介しておく必要があると思いました。今回は番外編1です。
さて本論文の着目点は4つあります。第1はPAの解説と本研究の目的です。これまでは肝臓ヒト化マウスの作製を目的とする論文の紹介をしてきました。しかし、この論文の目的はそうではなく、PAによる慢性肝病変の発生を肝細胞移植により改善できるかどうかを検討したものです。第2は方法論で、PAの投与法や肝細胞移植等の方法です。ラットの体重は、マウスの10倍程度ですので、違いがあるのか気になるところです。第3は、移植した肝細胞の効果の評価です。それでは結果を見ていきましょう。
1.PAの解説と本論文の目的
PAは、哺乳類の組織に幅広い毒性を示す天然由来の化合物群で、地球上にある被子植物(種子が果実の中に入っている植物)のうちキク科、ムラサキ科、マメ科などの一部を含む、約6000種の植物(被子植物の約3%に相当)に含まれていることが知られています。植物は、自らの種を残すために、天然毒素を自ら作り出して、花、根、種子等が動物に食べられないように守っています。そのような天然毒素の一つがPAです。実際に、野生の草食動物は、PAを含む植物を好んで食べないことが知られています。
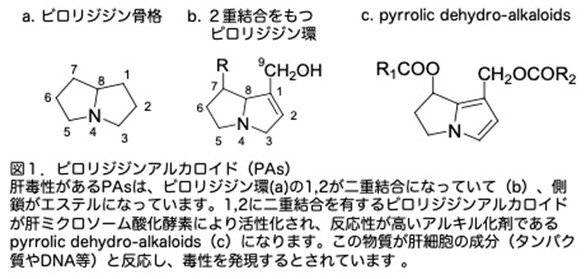
PAは肝臓で大部分が代謝され、数時間から数日で活性のあるピロール誘導体に変化します。図1aはピロリジジン環の基本構造で、肝毒性があるPAsはピロリジジン環の1,2が二重結合になっていて(図1b)側鎖がエステルになっています。1,2に二重結合を有するピロリジジンアルカロイドが肝ミクロソーム酸化酵素により活性化され、反応性が高いアルキル化剤であるpyrrolic dehydro-alkaloids(図1c)になります。この物質が肝細胞の成分(タンパク質やDNA等)と反応し、毒性を発現するとされています。
このPAは肝臓にさまざまな病変を誘発することが実験的に示されています。これには、急性肝細胞壊死、細胞分裂阻害、巨細胞小症、胆管増殖、線維症および肝硬変、肝発癌の誘発が含まれます(Schoental and Magee J. Pathol. Bacteriol. 74:305-319, 1957; Svoboda and Reddy Cancer Res. 32:908-912, 1972)。これらの病変が生じる理由として、細胞分裂を抑制する作用により細胞分裂は起こらないが、細胞周期が何度も繰り返されるために、肝細胞が肥大するためではないかと考えられています(Jago et al. Am. J. Pathol. 56:405-421, 1969)。胆管増殖は、PAへの暴露中に観察されますが、肝細胞増殖が損なわれた状態と関連しているようです。またPAは、繰り返し投与された場合、肝臓に対して発がん性があるようです。
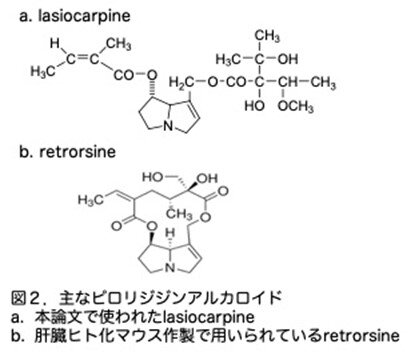
PAの作用は驚くほど長期に持続するようです。PAの一つであるラシオカルピン(LC)(図2a)を単回投与したラットでは、肝部分切除後の肝再生抑制効果が投与後12週間まで認められています。さらに、PAで誘導された巨大肝細胞はラットの肝臓で2.5年まで持続すると報告されています。従って、これらの化合物による長期にわたる細胞周期のブロックとそれに関連した持続的な分裂阻害環境は、肝臓に誘発される病変の重要な因子であると思われます。なお、コラム第13話で紹介しようとしたretrorsinもPAの一種で、その構造を図2bに示しました。
本論文では、PA曝露後のラットに別のラットから単離した肝細胞を移植することで、慢性肝病変の発生を阻止できる可能性があるかどうかを検討しています。化学物質が完全に代謝された後に移植された正常な肝細胞は、もはや化学物質の阻害作用は受けないはずです。したがって移植した正常な肝細胞が増殖環境の復元に寄与できるかどうかを解析するのが本研究の目的です。
2.方法論
実験には2ヶ月齢の雄性Fischer 344ラットを用いています。LCは0.1NのHC1に溶解し、NaOHでpH6に調整しています。16匹のラットにLC(80μmol/kg i.p.)を単回注射していますが、うち6匹のラットが急性毒性により投与後1週間以内に死亡しました。注射の4週間後、生存していた10匹すべてに2/3部分肝切除(partial hepatectomy: PH)を行い、5匹のラットには培養液のみを投与しています(グループ1)。残りの5匹のラット(グループ2)にはPHの際に正常肝臓から単離した肝細胞を移植しました。肝細胞は、以前に報告されたように、コラゲナーゼ灌流法に従って、6週齢の正常な同系ラットより単離しています。細胞の生存率はトリパンブルー染色によって判別し、85%以上でした。細胞は、10%の仔牛胎児血清を含むWilliam's E培地に懸濁して移植用に調製しています。各動物には、門脈から0.5mlの培養液に懸濁した106個の肝細胞を投与しています。余談ですが、表1に示しましたようにラットの体重はマウスの12~14倍程度、肝臓重量は6.5~7.8倍程度です。注入した溶液量がマウスの場合の50μlからその10倍の500μlは頷けるのですが、移植する肝細胞数は1x106とマウス同じで、ラットにはちょっと少ないような気がします。また、マウスでも門脈からの移植は可能ですが、出血が多いのでほとんど行われておらず、現在は脾臓経由が標準です。手術から14週間後、両群のラットから肝臓が摘出され、表面と切片の両方で解析されました。組織切片の形態測定(巨細胞化の程度、肝細胞核のサイズと密度)は、コンピュータ支援画像解析装置(LECO 2005; Leco, Montreal)を用いて行っています。無作為に選んだフィールドから、各ラットで約2000個の核を解析しています。
解析は、PA投与後に部分肝切除を行った群(グループ1)とPA投与後に部分肝切除を行ない、その後に肝細胞を移植した群(グループ2)における肝臓の絶対重量、相対重量、巨大細胞症の程度、肝細胞核のサイズおよび密度の比較しています。
3.移植した肝細胞の効果
肝細胞移植を受けたラットの最終体重は、対照群と比較して少し増加しましたが、有意ではありませんでした。肝臓の絶対重量および相対重量(肝重量/体重)は移植群で有意に高くなりました(表2)。このような肝重量の増加は脂肪の蓄積によることもあるのですが、肉眼的にも組織学的にも、それを示す証拠はありませんでした。肉眼的検査(画像結果は示されていません)では、グループ1の動物の肝臓は正常よりかなり小さく、肝臓再生がLC暴露の18週間後も阻害されていることが示されました。この所見は、Hayesらの所見と同じで、彼らはLCの単回暴露後12週間までPH後の肝再生が阻害されたことを報告しています。白っぽい灰色の結節が、表面と切片の両方に2-10個/肝臓存在しました。このグループの5匹中3匹に腹水が認められました。肝細胞移植を受けたグループ2の動物の肝臓も正常よりは小さかったのですが、グループIの肝臓よりは大きくなっていました。これらの肝臓は赤褐色で、表面は比較的滑らかでした。白っぽい灰色の結節も、腹水も見られませんでした。

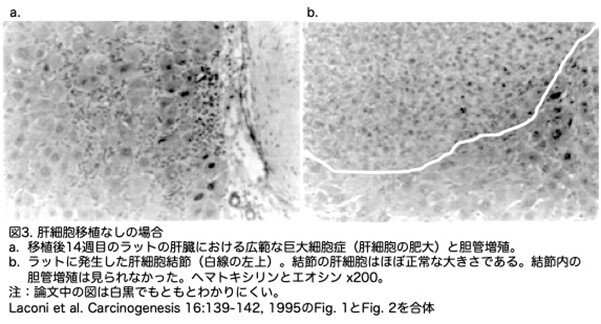
組織学的所見としては以下の通りです。グループ1のラットの肝臓には肥大した肝細胞(巨細胞)が広範囲に存在し、胆管増殖が顕著でした(図3a)。さらに、このグループのすべての動物の肝臓に肝細胞結節が認められました(図3b)。興味深いことに、これらの結節を構成する肝細胞の大きさはほぼ正常でした。これらの所見は、すでに他の文献に記載されているものと同様でした。PAが誘発する巨大細胞症は、PAへの曝露により細胞増殖の刺激は行われるが、有糸分裂を介さずに繰り返される細胞周期に由来するという仮説があります。
対照的に、グループ2のラットでは、巨大細胞がほとんど見られず、胆管増殖もなく、その結果、組織構造は正常肝臓に類似していました(図4)。さらに、これらのラットでは、肝細胞結節も認めませんでした。いくつかの組織学的所見のデータを表3に示します。肥大した肝細胞が占める面積の割合(%メガロサイトーシス)は、グループ1の肝臓では88±2%でしたが、グループ2の肝臓ではわずか2±1%でした。肝細胞核の平均断面積は、グループ1の動物ではグループ2の動物に比べてほぼ4倍大きいことがわかりました。これは、核密度、すなわち核の数/単位面積にも反映されており、グループ1と比較してグループ2のラットでは約4倍高値でした(表3)。

以上の結果から、正常肝細胞を移植すると、巨大細胞症や胆管増殖など、ラットの肝臓でLCによって誘発される慢性的な変化の発生を、ほぼ完全に抑制することができました。つまり、LC投与4週間後にレシピエント動物に移植された正常細胞は、曝露された肝細胞ではLCによる持続的な阻害作用が継続しているにもかかわらず、その影響を受けにくいと思われました。これは、PAが投与後数時間から数日で代謝されてしまうためで、4週間後に移植された細胞には直接影響を与えないと考えられます。従って、これらの肝細胞は、PHによる作用で生じた増殖刺激は受けることができ、肝実質全体で再増殖し、元の肝臓でLCにより持続的に抑制されている肝細胞に取って代わることが考えられました。これは、移植した肝細胞がuPA遺伝子産物により死滅する肝細胞に取って代わることが示された最近((1995年当時という意味です)の報告(コラム第4話で紹介した「Rhim et al. Science, 263: 1149-1152, 1994.」)と同じ状況と思われます。
結論として、この研究は、化学的に誘導された慢性肝疾患が、単離された正常な肝細胞の移植によって抑制あるいは回復されうることを示しています。
次はコラム番外編2です
この論文を読むと基礎研究のあり方とその位置付けを認識できます。いつ頃からか我が国の基礎研究にも、競争による選択と集中という概念が持ち込まれました。後にこの方針が「新しい研究の芽を摘み、日本の研究力を弱体化した」と言われることになります(ノーベル賞を受賞した大隅良典博士も言っておられます:https://gendai.media/articles/-/99751?page=3)。最初の研究は目立たない内容で、とても研究費が取れる内容ではないと思われても、その後地道に研究を続けることによって、やがて注目される内容へと発展するものが出てくるという、基礎の研究のあり方を理解していただく上でいい見本になると思いました。つまり基礎研究の最初の段階では海のものか山のものかわからず誰も評価できないのが普通で、諦めずに研究を継続すると、一定の確率で素晴らしい研究に発展する、つまり裾野の広さが(下手な鉄砲、数撃ちゃ当たる)重要ということを理解していただきたいと思います。ピロリジジンアルカロイドの肝細胞障害の研究が、これを利用した肝臓ヒト化マウス作製に応用できるとは予想外のことで、こういうのをセレンディピティ(serendipity)、何かを探しているときに、探しているものとは別の価値があるものを偶然見つけることというのでしょう。私見ですが、オリジナリティー(独創性)の高い研究は、競争からではなく、好奇心や興味から生まれるものだと思います。独創性の高い研究が生まれた後は競争的資金により質の高い研究が生まれるかもしれませんが、それはオリジナリティーとは別物です。つまり、これは研究費の配分とも関連することで、何でもかんでも競争的資金にすると、将来の芽になる研究は出てこないことを意味し、芽になる研究を育てるためには、誰も評価できないのですから、言葉は悪いのですが研究費をばらまくということが必要ということです。
次回は、コラム13話 番外編2として、retrorsineによるラット同種移植による肝臓置換効率の向上の論文(Laconi et al. Long-term, near-total liver replacement by transplantation of isolated hepatocytes in rats treated with retrorsine. Am. J. Pathol. 153 319 329 1998)を紹介したいと思います。