肝臓ヒト化マウスの歴史 第12話
ジェノミクス事業本部 金指英樹
既存モデルの問題点
これまでご紹介してきましたように、最初の肝臓ヒト化マウスはurokinase 型のプラスミノーゲンアクチベーター (plasminogen activator: PA) のトランスジェニック (Tg) マウスでしたが、根本的な問題をいくつか抱えており限界がありました。その後に開発された他のモデルにおいてもいくつかの問題があり、より使い勝手の良いモデルの開発が望まれました。今回のコラムでは、新しいモデルの肝臓ヒト化マウスを作製した2011年に発表された論文「Hasegawa et al. BBRC 405:405-410, 2011」を紹介します。
肝臓ヒト化マウスは、マウス肝臓で肝障害を起こさせるための遺伝子改変と、ヒト肝細胞を移植するための遺伝子改変で構成されています。前者の遺伝子改変には、uPA-Tgマウスとフマリルアセト酢酸ヒドロラーゼ (Fah) のノックアウト (Fah-KO) マウスがあり、後者には免疫不全を起こさせる遺伝子改変があります。新しいモデルは前者の遺伝子改変の内容となります。なお、後者の免疫寛容モデルについては、研究開発コラム第11話の表1に紹介されています。
uPA-Tgマウスモデルは、系統樹立の経緯にまつわる研究開発コラム第2話で紹介されたとおり、繁殖効率が悪いという問題点があります。加えて、第10話の冒頭でも言及されたように腎疾患を発症すること、ヒト肝細胞を移植するまでの期間が短いことなどの問題点があります。
Fah-KOモデルについては、移植されたヒト肝細胞の生着を促進するためにuPA発現を要する場合があり(第10話 3.肝臓ヒト化マウスの作製法)、この場合にはuPA-Tgモデルと同じ問題点が生じます。また、Fah欠損によりチロシン分解経路の最終産物の一歩手前が分解できず、毒性のあるフマリルアセト酢酸等の蓄積により肝障害や腎障害が起こり、結果としてⅠ型チロシン血症となります。さらに、肝臓がんも合併してしまう場合もあります。Fah-KOモデルの生存にはチロシン分解経路の阻害剤であるNTBC(2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione)(商品名Nitisinone)の投与で毒性の産物が生成されないようにすることが必須となり、一方で肝障害を起こすためにはNTBCを離脱させる必要があること、離脱とヒト肝細胞移植のタイミングが難しいなどの問題点があります。肝臓ヒト化マウスを作製するためにはヒト肝細胞の移植が必須となり、双方のモデルに共通することとして移植のタイミングに問題を抱えていることが分かります。皆さんが研究者だとしたら、肝細胞の移植のタイミングをよりコントロールしたいと思いませんか?コントロールできれば、課題が1つ解消されて、肝臓ヒト化マウス作製がもっと効率よくできるようになると思いませんか?

既存モデルの限界を克服するために
1.新たな実験系
そこで利用することを考えた実験系が、HSVtkによる細胞障害の系となります。まず、この実験系について、簡単に説明したいと思います。HSVtk(ヒト単純ヘルペスウイルスⅠ型チミジンキナーゼ)とは、ヘルペスウイルス由来のチミジンをリン酸化する酵素です。チミジンとはヌクレオシドの1つで、大雑把にいうとDNAを構成する4つの塩基(AGCT)の『T』といえばイメージできると思います。DNAは、五炭糖(デオキシ-D-リボース)に塩基(アデニン(A)、グアニン(G)、シトシン(C)、チミン(T))とリン酸基が結合したものから構成され、ヌクレオシドとは五炭糖と塩基だけが結合した化合物で、チミジンがリン酸化されるとチミジル酸というヌクレオチドとなります(図1)。三リン酸化されたヌクレオチドは、DNA合成の際に取り込まれていきます。HSVtkの特徴として、マウスが元来もつ内在性のチミジンキナーゼではリン酸化されないチミジンの類似体であるGCV(ガンシクロビル)などをリン酸化することができます(図1)。GCVがリン酸化されると内在性のグアニル酸キナーゼと内在性のチミジンキナーゼによって三リン酸化され、これがDNAの合成時に取り込まれ、結果的にDNA複製を阻害することとなります。結果として細胞が死滅します。この実験系を利用すれば、HSVtk遺伝子が肝臓だけで発現するマウスを作製して、そのマウスにGCVを投与することで、投与したタイミングで肝細胞を死滅させることができると考えられます。つまり、肝細胞移植のタイミングを、GCV投与のタイミングでコントロールできそうだから、試してみようという発想の試みとなります。それでは、その試みの内容を見ていきましょう。
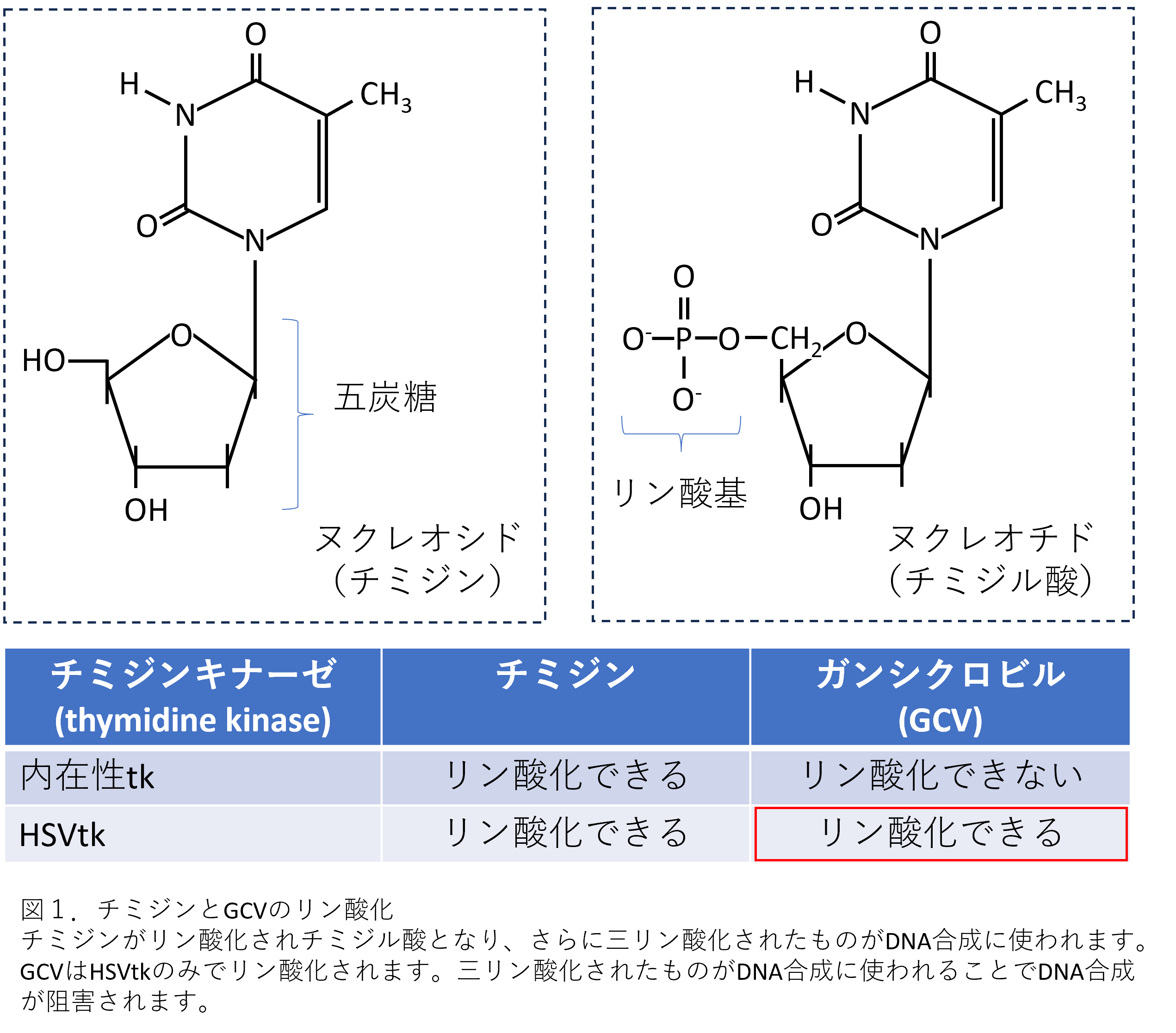
2.Alb-HSVtkトランスジェニックマウスの作製
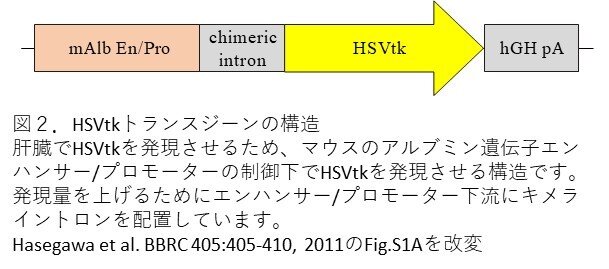
まず、HSVtk遺伝子を肝臓で発現させるために、肝臓特異的なアルブミンプロモーターの制御下でHSVtk遺伝子を発現させる、遺伝子発現ベクター(Alb-HSVtk)を構築しました。発現ベクターとは発現させたい遺伝子を運ぶための環状のDNAで、その配列には目的の遺伝子を発現させる構造の他に、宿主内でDNAを複製するための配列などが含まれています。この発現ベクターから目的の遺伝子発現ユニットのみとしたものをトランスジーン(図2)として高度免疫不全のNOGマウスに導入して、Alb-HSVtkをもつNOGマウス(TK-NOGマウス)を樹立しました。第11話で新しいレシピエントマウスとして紹介された高度免疫不全NOGマウスを本文献でも用いています。
実は、TK-NOGマウスにも問題があります。HSVtkのトランスジェニックマウスは雄性不妊のモデル動物のため、アルブミンプロモーターで肝臓特異的に遺伝子発現させているとは言え繁殖に大きな問題があると想定されます。論文にはさらっと記載されているだけでしたが、TK-NOGマウスの雄も不妊であることが分かりました。繁殖のためには、TK-NOGマウスの雌しか用いることができませんので、TK-NOG雌マウスとNOG雄マウスの交配をすることとなります。雌マウスの産子数は約6匹ですので、メンデルの法則に則れば半数がAlb-HSVtkトランスジーンをもち、さらにその半数が雌マウスということになります。生まれたマウスは100%離乳するわけではありませんので、1腹から得られるTK-NOG雌マウスは1~2匹となります。ご想像の通り、繁殖どころか系統の維持が精一杯という状況に陥りかねません。筆者らは60以上の繁殖ペアのコロニーを確立して、1636匹から797匹のトランスジェニックマウスを得たとのことですので、大変な困難と労力があったに違いありません。
話が少し逸れますが、現在ではHSVtkの変異型遺伝子(HSVtk-mt30)を用いることで、雄性不妊を回避できるマウスも作製されています。この変異型遺伝子は、ランダム配列変異導入法を用いて、ヌクレオシドアナログの中でGCVを優先的にリン酸化するHSVtk変異体として100万個以上の大腸菌形質転換体から単離されました。また、GCVと比較してチミジンのリン酸化程度が低いという特徴があります(Black et al. Proc. Natl. Acad. Sci. USA. 93, 3525-3529, 1996)。HSVtk遺伝子内には精巣特異的なプロモーター領域があり、精巣内におけるHSVtkの短い転写産物の発現レベルが高いと不妊につながる精子形成異常になるといわれておりますので、GCVの投与の有無に関わらず不妊となってしまいます(Al-Shawi et al. Mol Cell Biol. 11(8), 4207-4216, 1991)。これは、ラットで作製された下垂体特異的プロモーターでHSVtkを発現するFSHβ-HSVtk遺伝子トランスジェニックラットでも同様の報告があり、下垂体以外に精巣でもHSVtkが発現してしまい、不妊となります(Cai LY et al. J Reprod Dev. 53(2), 201-209, 2007)。一方、CD11bプロモーターのHSVtk-mt30では雄性不妊を回避できたとの報告(Uehara et al. Drug Metab Pharmacokinet. 42, 100410, 2022)もありますので、肝臓特異的プロモーターの制御下でHSVtk-mt30が発現するトランスジェニックマウスを作製すれば、雄性不妊を回避することができる可能性があると考えられます。実際に、HSVtk変異体のトランスジェニックマウスでは、雄性不妊が回避できました。
3.TK-NOGマウスへの肝細胞移植
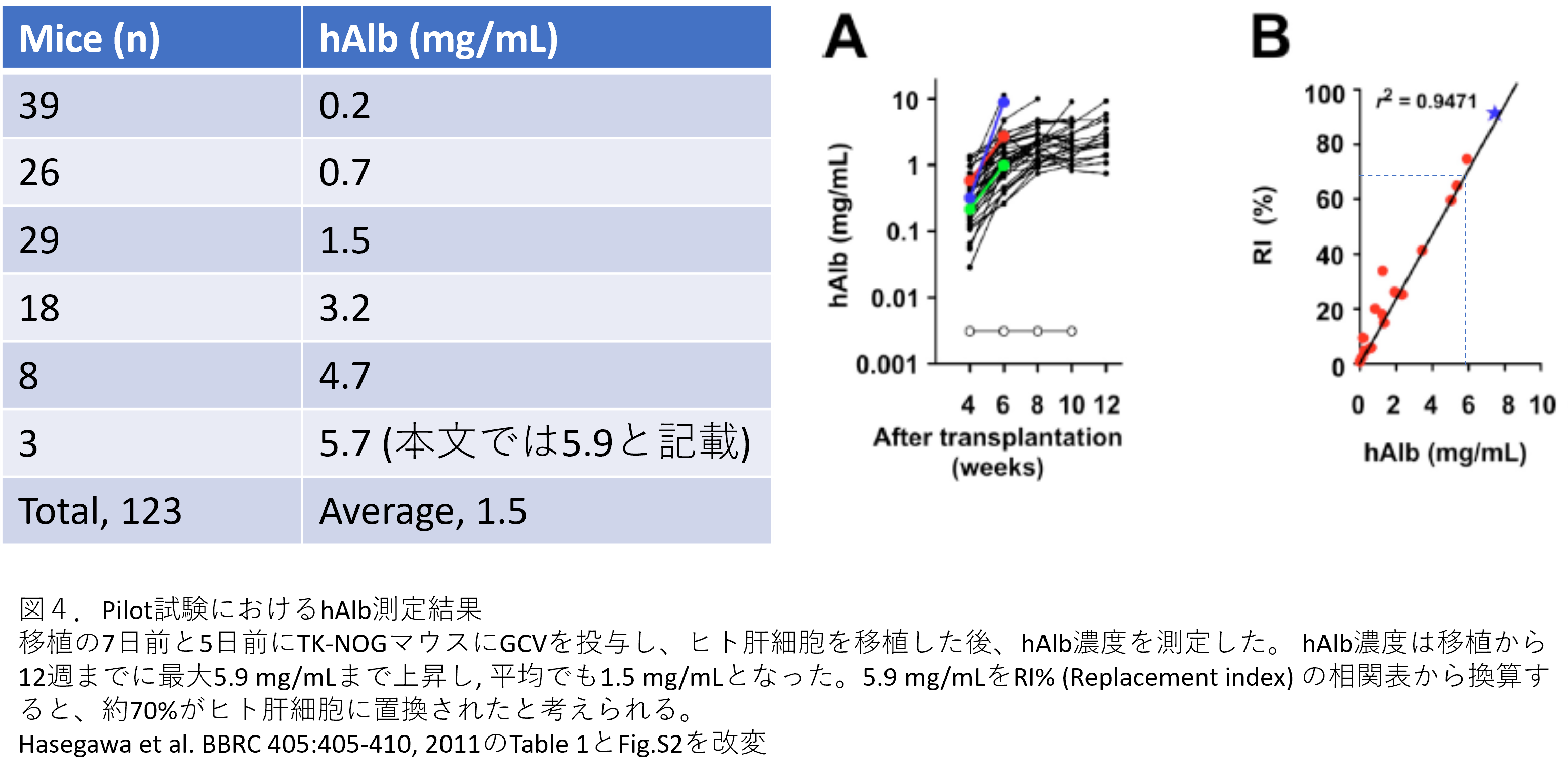
筆者らは樹立した貴重なTK-NOGマウスを用いて、肝細胞移植のパイロット試験を行いました。123匹のレシピエントであるTK-NOGマウスに移植の7日前と5日前にGCVを腹腔内投与して肝障害を起こさせた後、100万個のヒト肝細胞をそれらマウスの脾臓より移植しました。各マウスについて血漿中のヒトアルブミン濃度を測定しました。驚いたことに全てのレシピエントマウスについてヒトアルブミンが検出されました。その濃度は最大で5.9 mg/mLと高値で(図3左、A)、ヒトアルブミンの濃度とヒト肝臓の置換率には相関関係(r2 = 0.9471)があることから、その相関関係表からヒト肝臓への置換率を換算すると70%近い置換率となりました(図3B)。平均でも1.5 mg/mLでしたので、期待が持てる結果となりました。
検討の段階でうまくいくと、研究者としては俄然やる気が出ます。移植時のマウスの週齢やGCV投与の量とタイミングなどの条件を最適化して43匹のレシピエントマウスで同様の試験をした結果では、血中hAlb濃度が平均3.3 mg/mL(平均43%)と大幅に上昇しました。この結果は、Fah-KOモデルにおいて2010年に発表された結果(Bissig et al. J. Clin. Invest. 120, 924-930, 2010)と同じレベルで、移植細胞数を最適化することでさらに肝臓のヒト・マウスのキメラ率を高めることができる可能性があります。さらに重要なこととして、TK-NOG肝臓ヒト化マウスでは、移植前に投与されたGCV以外の投薬を受けていないにもかかわらず、8カ月という長期に渡り高い血漿中のhAlb濃度が維持され、体重の減少も確認されませんでした。このような長期生存はuPA-Tgモデルでも達成されておらず、Fah-KOモデルでは長期生存(約8カ月)はするものの肝細胞がんの発生を防ぐためにNTBCの投与と離脱を繰り返す必要がありました。
以上のことから、TK-NOGマウスはGCVの事前投与のみで肝細胞移植が可能であり、移植後の長期生存と移植後のレシピエントマウスのケアも比較的楽だという3つの利点があることが分かりました。
新規モデルは肝臓機能を有するのか
さて、作製されたTK-NOGマウスのヒト化肝臓について、期待したヒト肝臓の機能をもつのでしょうか?そこで、4つの視点から肝機能を調べた結果について、以下にまとめました。まずは、基本的な解析として血清と血液について調べた結果を見てみましょう。
【血清のイムノブロット解析と血液検査】
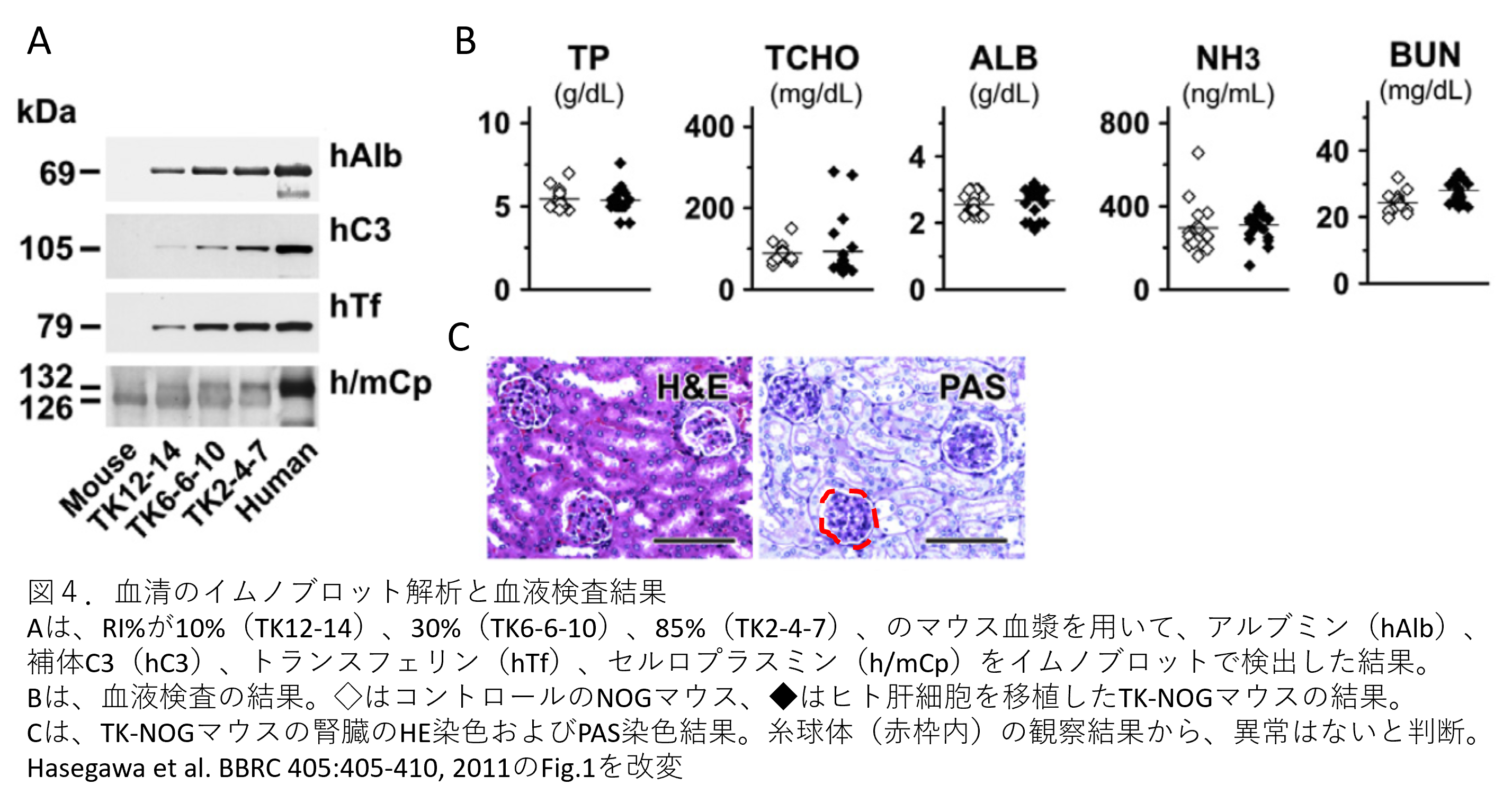
- 図4Aはイムノブロット解析の結果になります。イムノブロットの結果、複数の異なるヒトタンパク質(hAlb(アルブミン)、hC3(補体C3)、hTf(トランスフェリン)、h/mCp(セルロプラスミン))が検出されています。TK12-14はReplacement index(RI)%が10%、TK6-6-10は30%、TK2-4-7は85%の肝臓ヒト化マウスになりますので、RI%に相関してヒトタンパク質の量が増えている(バンドのシグナルが段階的に強く検出)ことが分かります。
- 特に補体hC3の結果では、105 kDaにバンドが検出されています。肝臓でつくられた補体C3は血液でC3aとC3bに分解されます。105 kDaというサイズはC3aを示していますので、補体C3がC3aとC3bに分解されたことを示しています。この結果は興味深く、C3の血中濃度が高いとC3腎症の一因となると過去に報告されています(コラム第8話参照)が、図4B血液検査のBUN値と図4Cの腎臓組織のH&E染色およびPAS染色の結果から、腎不全の生化学的・組織学的証拠は確認されませんでした。
- 図4Bの血液検査(TP, TCHO, ALB, NH3)結果から、ヒト化肝臓は正常な合成代謝機能があると考えられました。
血清のイムノブロットおよび血液検査の結果では、ヒト肝臓機能を持っていそうだということが分かりました。次に、ヒト肝細胞が本当に肝臓内に存在しているのか、目で見て確認したいと思いませんか?目で見て確認することは非常に大切なことですので、組織切片を作製して顕微鏡で観察した結果を見てみましょう。
【組織像の解析】
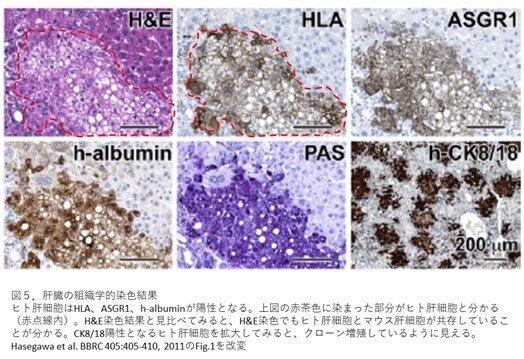
- 図5は、肝臓ヒト化マウスの肝臓をホルマリン固定し、5 μmの連続切片にしたものを染色した結果です。ヒト肝細胞は、ヒトタンパク質であるHLA、ASGR1、h-albuminを標的とした免疫組織学的染色を実施すると陽性となります。染色画像を見てみますと赤茶色に染まった領域が陽性の細胞になりますので、ヒトタンパク質をもつ細胞がある、つまりヒト肝細胞が存在していることが分かります。なお、各図の右下のバーは、100 μmというスケールを示しています(h-CK8/18は200 μm)。
- H&E染色の結果を見てみましょう。H&E染色とは組織染色では基本となる染色法で、細胞核(青紫)と細胞質(赤紫)を判別できます。マウス肝細胞の特徴として細胞質が比較的酸性になりますので、赤紫色が濃くなります。比較的白く抜けている領域(赤点線枠)はヒト肝臓に特徴的で(第11話図5参照)マウス肝細胞ではなさそうだということが分かります。免疫組織学的染色の結果と見比べると、赤点線枠領域がヒト肝細胞の領域と一致しますので、ヒトとマウスの肝細胞を明確に区別できていることが分かります。
- PAS染色は、多糖類に反応して濃い赤紫に染色されます。肝臓にはグルコースから多糖類であるグリコーゲンを合成して貯蔵し、逆にグリコーゲンからグルコースに分解して血液に供給する機能があります。つまり、肝臓の切片をPAS染色することで、グリコーゲンの蓄積を判別することができます。肝臓ヒト化マウスでは、グリコーゲンの蓄積は、ヒト肝細胞だけで認められました。ヒトとマウスのキメラ肝臓においては、ヒト肝細胞だけにグリコーゲンの蓄積が認められることが知られており、この知見に関して知りたい方は、「Meuleman et al.Hepatology 41:847-856,2005」を読まれて下さい。
- h-CK8/18による染色結果を見てみましょう。この図は、ヒト肝細胞領域を3~4倍程度拡大したものとなります。h-CK8/18で染色することでヒト肝細胞のみが特異的に陽性となります。拡大したところ、ヒト肝細胞が1つの細胞クローンから増殖してコロニーを形成しているように観察されました。
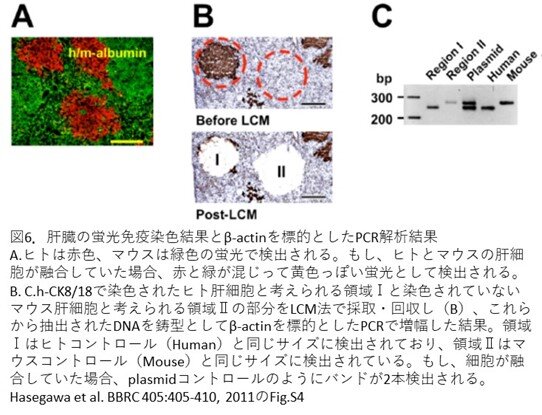
- さらに、ヒトとマウスの肝細胞が融合してしまっているのではないかという疑問もあります。そこで、2つの実験を行っています。一つ目は、アルブミン特異的な抗体による蛍光免疫染色です。ヒト肝細胞は赤色、マウス肝細胞は緑色の蛍光で検出され、もし、ヒトとマウスの肝細胞が融合していたとしたら、赤と緑が混じり黄色として観察されると予想されます(第10話図7参照)。図6Aの結果、融合を示すような蛍光を発している細胞は観察されませんでした。2つ目は、ヒトとマウスのβ-actin遺伝子を標的としたPCR解析です。まず、h-CK8/18で染色された切片を作製し、LCM法(Laser-capture microdissection, LMD法ともいう)を用いて、染色されたヒト肝細胞と考えられる領域Ⅰと染色されていないマウス肝細胞と考えられる領域Ⅱを採取します(図6B)。これらからDNAを抽出し、ハウスキーピング遺伝子の1種であるβ-actin遺伝子をPCRで検出します(図6C)。領域Ⅰはヒトコントロールと同じサイズに検出されており、領域Ⅱはマウスコントロールと同じサイズに検出されています。もし、細胞が融合していたとしたら、plasmidコントロールのようにバンドが2本検出されますので、それぞれ、ヒト肝細胞、マウス肝細胞のみであり、細胞融合はないと考えられます。
目で見て確認することで、ヒト肝細胞がマウス肝臓内に移植された後、クローンから増殖してコロニーを形成し、マウス肝細胞と融合することなく共存していることが分かりました。
そもそも肝臓ヒト化マウスを作製している一番の理由は、薬物動態などの研究をヒトで実施することはできませんので、よりヒトに近い実験動物モデルとして樹立し、研究利用することです。つまり、ヒト肝細胞が存在するだけでなく、薬物動態に関わる遺伝子群がヒトと同じように機能していることが重要になります。そこで、それらの遺伝子群に関して解析しています。
【遺伝子プロファイル解析】
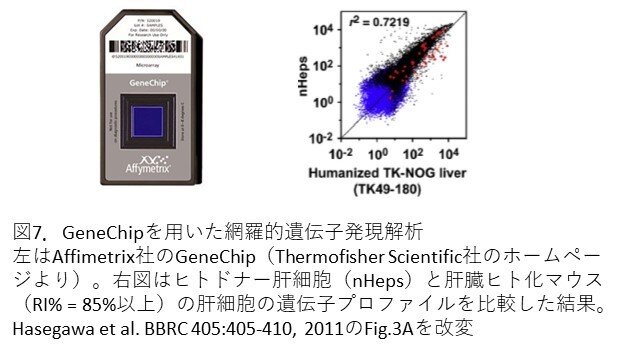
- ヒトの遺伝子数は、約23,000といわれています。これらを一つずつ解析することは困難ですので、GeneChip(図7左)を用いたアレイ解析を実施しています。このGeneChipには、約38,500もの遺伝子が含まれていますので、網羅的かつ発現遺伝子を包括的に解析することができます。GeneChipの遺伝子数が、ヒトの遺伝子数より多いなと思うかもしれません。これは、約23,000という数はタンパク質をコードする遺伝子数ですので、GeneChipに含まれているものはRNAとして転写されているがタンパクは作らない遺伝子も含めた数となります。遺伝子発現プロファイルを比較した結果、ヒト化肝臓(TK-49-180)とドナーヒト肝細胞(nHeps)のプロファイルに高い相関関係(r2 = 0.7219)がありました(図7右)。
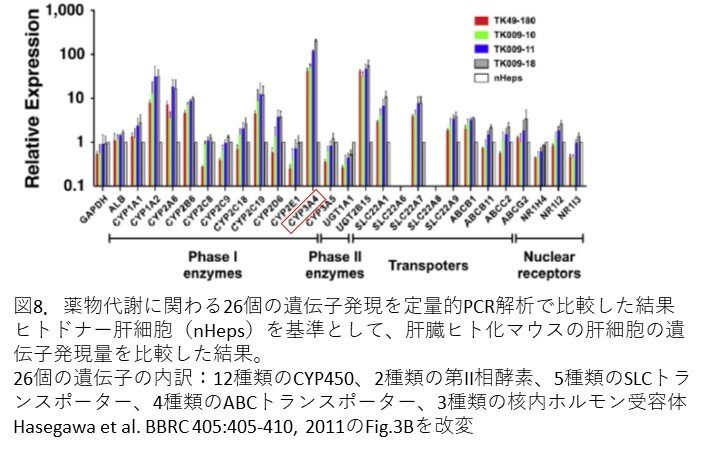
- 次に薬物代謝に関わる26個の遺伝子について、定量的PCR法によるmRNAの発現レベルをドナーとして用いたヒト肝細胞(nHeps)の結果を基準として比較しています(図8)。その結果、ドナーヒト肝細胞で発現していたmRNAは、ヒト化肝臓でも同程度のレベルで発現していることが確認されました。ちなみに、先程のGeneChipの結果と高い相関関係を示していることも確認されています(r2 = 0.9784)。また、CYP3A4遺伝子が特に豊富に発現していました。CYP3A4は薬物代謝に関与するCYP450酵素ファミリーの一つで、市販薬のおよそ50%を代謝することができる酵素です。
遺伝子の発現プロファイルの結果から、肝臓ヒト化マウスの肝細胞は、ヒトのドナー肝細胞と高い相関があることが分かりました。最後に、実際にそれら遺伝子が機能しているか、ヒト特異的な薬物代謝が起こるのか確認しています。
【ヒト特異的な薬物代謝解析】
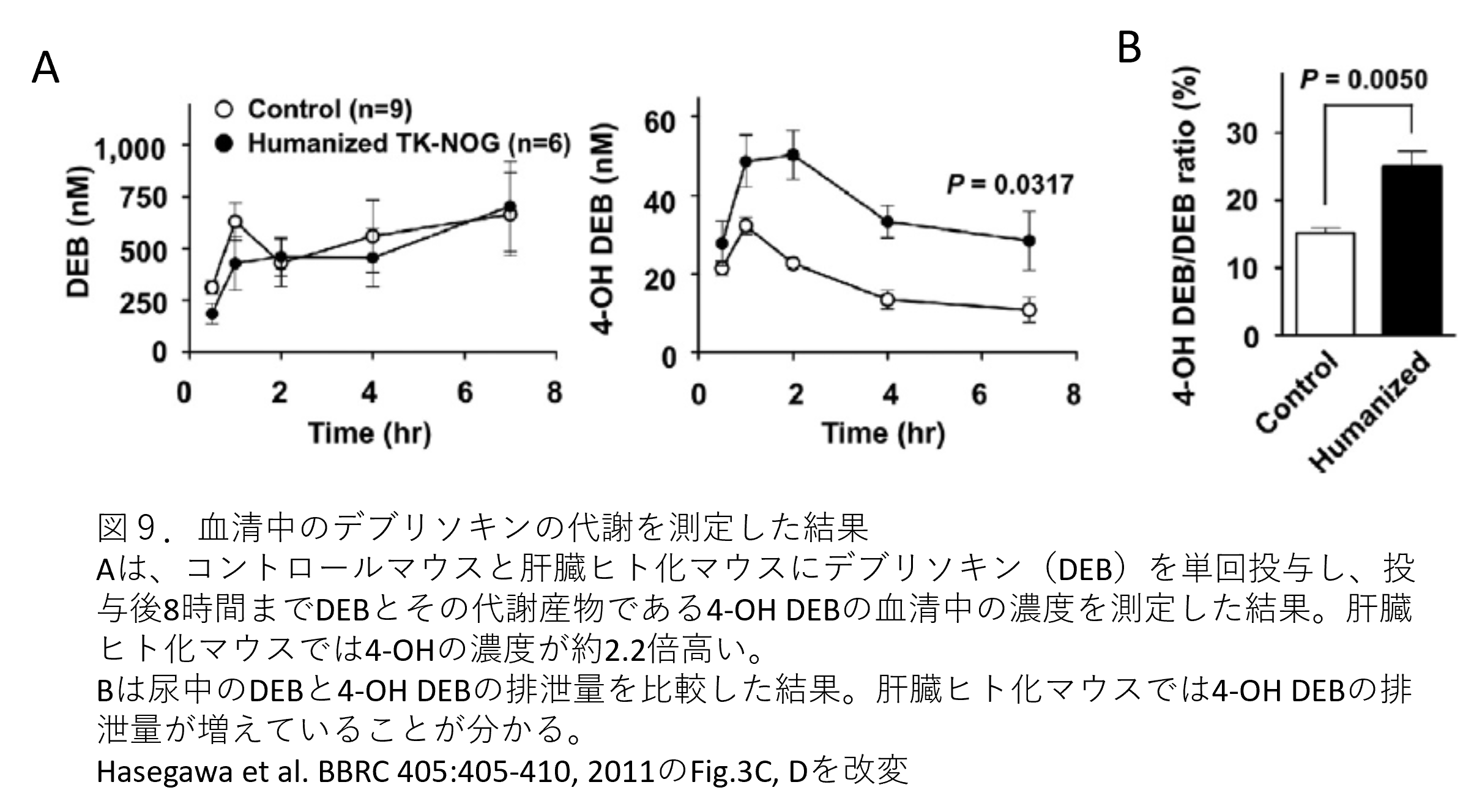
- マウスでは代謝が低いデブリソキン(DEB)を用いて、薬物代謝が起こるか試験を行っています。市販薬の約30%を代謝することができるCYP2D6の基質の一つが、デブリソキンです。その代謝産物である4'水酸化体DEB(4-OH DEB)の産生量を測定することで実際に代謝が起こっているか確認することができます。コントロールNOGマウスと肝臓ヒト化マウスにDEBを単回投与し、投与後8時間までの血清中のDEBおよび代謝産物である4-OH DEBを測定しました。その結果、DEBの血清中濃度に有意差はありませんでしたが、4-OH DEB産生量は約2倍の増加が確認されました(p = 0.0317)。DEBの代謝はマウスでは低いため、4-OH DEB産生量の増加は、ヒト肝細胞で発現しているCYP2D6によるものと考えることができます(図9A)。
- また、尿中4-OH DEB代謝物の排泄量が増加していたことから、ヒト化肝臓が生体内においてCYP2D6特異的な薬物代謝を仲介できることが示されました(図9B)。
以上の解析の結果から、TK-NOGマウスにヒト肝細胞を移植して作製された肝臓ヒト化マウスの「ヒト化肝臓」は、機能的な「ヒト臓器」であることが実証されました。
これまでの疑問点の再確認
- ヒトC3による腎障害
コラム第8話で紹介しましたが、ヒトC3の血清中濃度が高いと、uPAトランスジェニックマウスで発症する腎不全の一因になると考えられていました。しかし、その後の論文(コラム第10話)や本論文もふくめて、腎不全の生化学的・組織学的証拠は認められていません。この問題はあまり気にする必要はないのではと思います。 - マウスとヒトの肝細胞間の融合
これはコラム第10話で紹介しましたが、そこで引用された論文でサルのES細胞から誘導したembryoid body(胚様体)とヒト肝細胞が融合しているというデータが示されました。しかし、その第10話での論文でも、融合の証拠はありませんでした。また、この論文でも、ヒトまたはマウスのアルブミンに特異的な抗体による二重免疫蛍光染色、およびレーザーキャプチャー・マイクロダイセクションによって単離された組織内のゲノムセグメントのPCR分析から、マウスとヒトの細胞間の融合事象の証拠はないことが示されました。したがって、ヒトとマウスの肝細胞間の融合は起こらないと考えて良さそうです。 - 移植したヒト肝細胞はマウス肝臓内に組み込まれ正常な組織構築ができるのか
コラム第10話でも論点の一つとして取り上げました。本論文では、以下のような記述があります。「グルタミン合成酵素(GS)は通常、肝小葉の中心静脈周辺の狭い領域で発現していることから、コントロールNOGおよびヒト化TK-NOG肝臓における発現パターンを調べた。移植6週後のヒト肝細胞を含む肝小葉内では、帯状のGS発現の証拠はなく、この時点では小葉の組織が未成熟であることが示唆された(データは示さず)。一方、移植後14週目には、TK-NOG肝臓のヒト由来領域でGSは中心静脈周囲に発現していた。したがって、14週後には、TK-NOGマウスの再構成ヒト化肝臓で成熟した肝構造が形成されている。これは、自家肝細胞移植の8週後にゾーニングが起こることを示した先行研究と一致している[Braun et al. Nat. Med. 6:320-326,2000] (この文献には移植14日後ではまだで、56日後には正常に形成されると記載されています)」。ということで、不思議にも移植したヒト肝細胞は、時間と共に肝臓という複雑な構造の中で居場所を見つけ、マウス由来の血管や胆管と協調して肝機能を果たしているようです。
終わりに
今回の論文では、既存モデルの問題点を克服するため、HSVtkとGCV投与による細胞障害システムを使った新たなモデルマウス(TK-NOG)の樹立経緯についてご紹介いたしました。この肝臓ヒト化マウスはヒト肝臓機能をもつことが実証され、Fah-KOモデルで使われるNTBCのような維持薬を使うことなく長期間飼育できるというメリットもあり、有用なマウスであることが示されました。さらには、作製した肝臓ヒト化マウスにGCVを追加投与することで、ヒトへの置換率を上昇させることができるかもしれません。
次回は、Retrorsineによる移植効率の大幅改善の論文「Michailidis et al. Proc Natl Acad Sci USA. 117:1678-1688, 2020」を紹介します。