肝臓ヒト化マウスの歴史 第11話
株式会社トランスジェニック 顧問 山村研一
新たなレシピエントマウスの開発
前回の論文では、肝臓で発現しているFah (Fumarylacetoacetate hydrolase)を欠損させ肝細胞を死滅させる系で、かつ免疫寛容にするため今までとは違う系を用いた新しいレシピエントマウス「Fah-/-:Rag2-/-:Il2rg-/-(FRGと略)」(Azuma et al. Robust expansion of human hepatocytes in Fah-/-/Rag2-/-/Il2rg-/- mice. Nat. Biotechnol. 25:903-916, 2007)の論文を紹介しました。今回は、新たなレシピエントマウスで、マウスの中では最も免疫寛容となっているNOG (NOD:PrkdcSCID/SCID;IL2rg-/-)マウスを用いた肝臓ヒト化マウスの作製の論文(Suemizu et al. Biochem. Biophys. Res. Commun. 377:248-252, 2008)を紹介したいと思います。
今回の着目点はす3つあります。第1は新しいレシピエントマウスとして「NOG」を用いています。NOGという新しく開発された免疫寛容マウスを応用したのが本論文の最大の特徴です。第2はNOGマウスの受精卵にAlbumin-uPA (Alb-Plau:ヒトAlb遺伝子のプロモーターをPlau遺伝子に接続したもの)を導入しNOG:Tg(Alb-Plau)を作製していますが、今までのAlb-Plau系統とはかなり違う表現型および肝組織像を持っていますのでそれを解説します。第3は、NOG:Tg(Alb-Plau)にヒト肝細胞を移植した時の生着率と置換率です。それでは順番に結果を見ていきましょう。
1.NOGマウスの免疫寛容状態の特徴
著者らはIL-2受容体ガンマ鎖欠損(IL2Rg-/-)マウスとNOD/Shi-scid (NOD/Shi: PrkdcSCID/SCID)(NODマウスはもともとはシオノギ製薬でI型糖尿病のモデルとして開発されましたので、系統名を記すときはその頭文字Shiが使用されています)を交配して、NOD:PrkdcSCID/SCID: IL2Rg-/-(NOG)マウスを開発しました。NOD/Shi-scid (NOD/Shi: PrkdcSCID/SCID は、免疫系をヒト化しHIVウイルス粒子がよく産生させるために開発されたものです(Koyanagi et al. J. Virol. 71 (1997) 2417-2424)。NOGマウスはTリンパ球、Bリンパ球、ナチュラルキラー(NK)細胞を欠損しており、樹状細胞の機能が低下しています。その重度の免疫不全状態のため、NOGマウスはヒト造血幹細胞(Ito et al. Blood 100 (2002) 3175-3182; Yahata et al. J. Immunol. 169 (2002) 204-209)や子宮内膜組織(Masuda et al. Proc. Natl. Acad. Sci. USA 104 (2007) 1925-1930; Matsuura-Sawada et al. Hum. Reprod. 20 (2005) 1477-1484)のヒト細胞や組織の移植のin vivoモデルとして用いられています。なおこのSuemizuらの論文には記載されていませんが、免疫寛容マウスにおける免疫細胞の欠損状態を表1にまとめておきました。これを見るとNOGマウスで欠損している免疫細胞が一番多いこと、したがってヒト肝細胞の生着が期待できることが分かります。この論文では、NOGマウス受精卵を用いて、Alb-Plau遺伝子を導入し、NOG:Tg(Alb-Plau)トランスジェニックモデルを開発し、ヒト化肝臓マウスを作製しています。
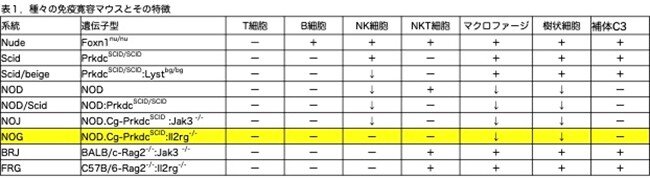
2.NOG:Tg(Alb-uPA)とこれまでのTg(Alb-uPA)との違い
まずは、コラム第3話で紹介した論文(Sandgren et al. Cell 66:245-256, 1991)で作製されたTg(Alb-Plau)の紹介から始まっています。Sandgrenらの論文では、Alb-Plauマウスの系統1353-8および系統1944-6において、それぞれ5コピー(Sandgrenらの原著では4コピーとなっている)または10コピーの導入遺伝子が導入遺伝子の頭から尻尾までの配列が同じ向きに隣り合って存在(これをタンデム配列といいます)していると記載されています。どちらの系統でも、トランスジェニック子孫の半数は広範囲に出血し、新生児期に死亡しています。新生児致死率はPlau導入遺伝子の発現レベルと相関しており、発現レベルはある程度コピー数によって決定されています。これまで紹介してきたTg(Alb-uPA)は、すべてSandgrenらが作製したマウスを用い、それぞれの免疫寛容マウスとの交配によりレシピエントマウスとして用いられていました。
しかし、Suemizuらは、Alb-Plau遺伝子の発現量が表現型に影響するため、Alb-Plau遺伝子のコピー数が少ないマウスは肝障害が少なく、新生児致死は少なくなると予測しました。そこでTg(Alb-Plau)を用いた交配によるのではなく、NOGマウス受精卵にAlb-Plau遺伝子(図1a)を導入することにより、新たにNOG:Tg(Alb-Plau)マウス系統を作製しました。そしてAlb-Plau遺伝子を持つNOG:Tg(Alb-Plau/+)マウス(以降ヘミ接合体と略)を作製し、ヘミ接合体マウスの交配によりホモ接合体NOG:dTg(Alb-Plau/Alb-Plau)マウス(以降ホモ接合体と略)を得ています。Plau導入遺伝子の発現を定量RT-PCRで解析した結果、ヘミ接合体およびホモ接合体の肝臓で発現していましたが、ホモ接合体マウスでの発現は、ヘミ接合体よりも2.4~3.6倍高いことが明らかになりました(データは示されていません)。しかし、腎臓、脾臓、および非トランスジェニックNOGマウスから得られたすべての組織では発現していませんでした(図1b)。
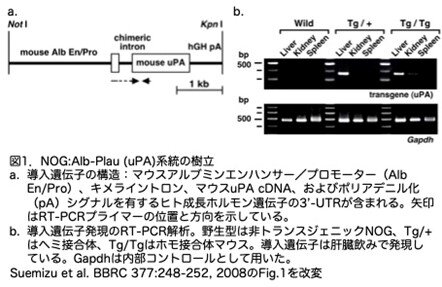
そして期待通り、ホモ接合体でも周産期出血、胚致死、新生児致死は起こりませんでした。生後4週齢における肝細胞障害の指標である血清ALT値(75.0±9.1、n=4)はホモ接合体の方がわずかに上回っていましたが、統計学的には有意差はありませんでした(データは示されていません)。しかし、6週齢ごろにホモ接合体ではALT値は上昇し始め、14週齢まで上昇したままでした(図2a)。一方、ヘミ接合体では血清ALT活性はいずれの年齢のマウスでも上昇せず、非トランスジェニックNOGマウスと同じでした(図2a)。このことはヘミ接合体における導入遺伝子の発現レベルは、肝疾患を引き起こすのに必要なレベル以下であると考えられました。
ホモ接合体の表現型および肝組織像は、以前に作製されたAlb-Plauマウスとは大きく異なっていました。以前のAlb-Plauホモ接合体マウスでは、3-6週齢に重度の浮腫が見られましたが、ホモ接合体では見られませんでした。また、3-5週齢のAlb-Plauホモ接合体の肝臓は滑らかで淡い色からほぼ白色で(''白肝''として知られている)、Alb-Plauヘミ接合体の肝臓も外観に著しい異常がみられ、白色の実質に加えて多数の赤みを帯びた結節(赤肝)がみられていました。しかし、6週齢のヘミあるいはホモ接合体では''白肝''はみられませんでした(図2b、左端)。6週齢のホモ接合体の肝臓には、軽度の肝障害の所見、つまり肝細胞は局所的に変性病巣を示し、主に中心静脈の周囲に数個の好酸球小体が認められました(図2b、中央)。16週齢では、好酸球の増加を伴う巨赤芽球症が認められています(図2b、右端)。
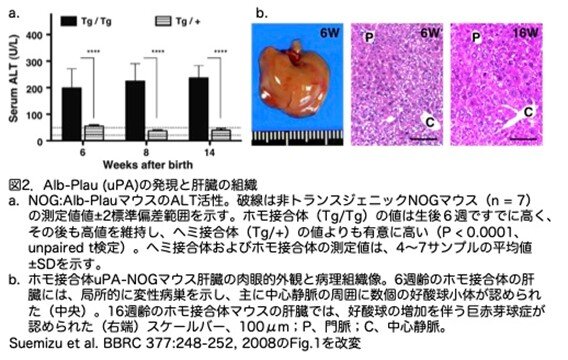
以前のAlb-Plauマウスでは、トランスジーンの一部欠失によってPlauの発現が加齢に依存して低下していきます。しかし、今回のホモ接合体では、サザンブロット解析から導入遺伝子が単一の遺伝子座に安定に組み込まれていることが示されました(図2a)。8週齢のホモ接合体マウスの肝臓と腎臓のDNAサンプルのバンドパターンに違いがなかったことは、導入遺伝子が物理的に失われる頻度が低いことを示しています(論文ではこのような記載がありますが、1ポイントだけのサザンブロット解析ではコピー数が安定しているかどうかは不明です。また、実際のLivとKidではバンドの濃さが違い安定していると言っていいか不明です。また図3aの上端XbaIのKid(Tg)にはバンドがなく、Kid(W)でバンドが検出されていますが、これは間違いで左端がKid(W)で3番目がKid(Tg)の間違いと思います。XhoIでも同じ間違いがあります。ただ図の説明文では正しく記載されていました)。また、Alb-Plau遺伝子の安定した発現レベル(図2a)および高レベルの肝障害マーカー(ALT)の持続も、導入遺伝子が安定に発現していることを示しています。XhoI消化後のバンドパターンをさらに解析すると、ヘミ接合体マウスは4.6kbの単量体導入遺伝子を少なくとも3コピー持っていることがわかりました。ヘミ接合体マウスにおける導入遺伝子の構造を、制限酵素を追加したサザンブロット解析によってさらに解析し(図3b)、組み込まれた導入遺伝子の制限地図を作成しました(図3c)。その結果、少なくとも3コピーのAlb-Plau遺伝子がタンデムに結合したものであると推定できました。下流に位置するPlau遺伝子発現ユニットの1つは、小さな再配列を有していました(図3cの黄色部分)。この遺伝子再配列はこの系統のファウンダーマウスで観察されたことから、後天的に獲得された特徴ではないと考えられます(データは示されていません)。
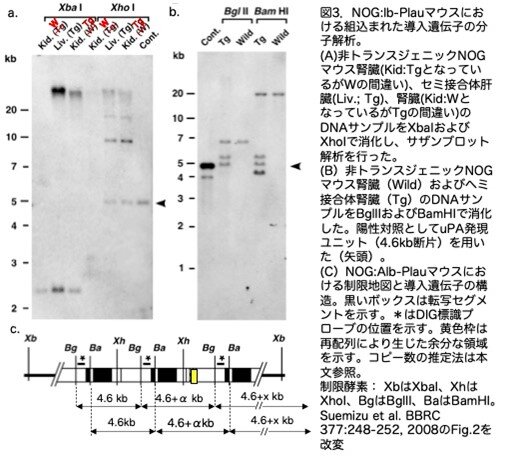
余談ですが、ここで組み込まれたコピー数の推定方法を説明しておきます。図3cに示していますが、3コピーの根拠は以下のとおりです。4.6kbのバンドがAlb-Plauの1単位として、それがタンデムに並んで組込まれると、トランスジーンの単位の中で1か所切断する制限酵素で切断すると理論上4.6kbのバンドが出現します。例えばBglIIで切断すると3本出るはずです。ただこの図場合、2コピー目に再構成が起き4.6+αの長さになるのと、3コピー目の右端のBglII部位はAlb-Plauの中にはなく右のマウスゲノムの中にあるので4.6kb+x kbの長さの断片が検出されます。もし、2コピー目に再構成等何も起こらなければ4.6kbとなり、このバンドの濃さが2倍になります。BglIIで切断した時3本が検出されており、それぞれ同じ濃度になっていますので3コピーが組み込まれたと判断しています。
また、以前に作製されたTg(Alb-Plau)マウスで典型的にみられた自然発生的な腸管出血や腹腔内出血は一度もみられませんでした。したがって、NOG:tg(Alb-Plau)マウスでは導入された遺伝子が低コピーであり発現量も低いため、新生児致死が起こっていない可能性があります。
3.NOG-Tg(Alb-uPA)におけるヒト肝細胞の生着率と置換率
NOG:Tg(Alb-Plau)が移植したヒト肝細胞生着と増殖をサポートできるかどうかを調べるため、市販の凍結保存ヒト肝細胞を6週齢のヘミ接合体およびホモ接合体マウスに移植しています。移植時、これらのマウスは健康でした。以下の項目に分けて結果を紹介します。
(1)体重の変化
ヒト肝細胞を移植されたヘミ接合体もホモ接合体も移植後に体重が増加しました(図4a)。ホモ接合体の方が体重が少なくみえますが、論文では特に述べられていません。
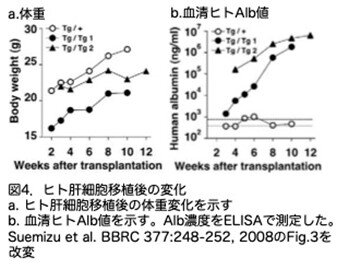
(2)血清ヒトAlbレベル
ヘミ接合体およびホモ接合体の血液中のヒトAlb濃度をELISA法および免疫ブロット法で定期的に測定し、ヒト肝細胞によるマウス肝臓の再増殖を推定しています。まずELISA法ですが、ヒト血清Albレベルはホモ接合体Tg/Tg1では1.8mg/mlに、Tg/Tg2では、6.5mg/mlまで増加しました。ヘミ接合体ではヒト血清Albレベルは低いままで、移植が成功したことを示すレベルではありませんでした(図4b)。なお、論文の図4bの説明で「破線は未移植のNOG:Alb-Plau(n = 6)の値の2標準偏差範囲を示す」と記載されていました。これは、本来検出されないはずですが、抗ヒトAlb抗体とマウスAlbとの交差反応によって測定値が出たが、意味のない数値という理解だと思います。ヘミ接合体もこのレベルなので、実質ヒトAlb検出できないという意味と思います。
免疫ブロット法では、解析した2匹のホモ接合体(Tg/Tg1およびTg/Tg2)の血清から、抗ヒトAlb抗体を用いてヒトAlbが検出されましたが、ヘミ接合体から得られた血清では、ヒトAlbは検出されませんでした(解析したマウスの週齢は書かれていません。データ省略)。一方、マウスAlbはすべての血清で検出されました。これはホモ接合体においてもマウス肝細胞が残存していることを意味します。
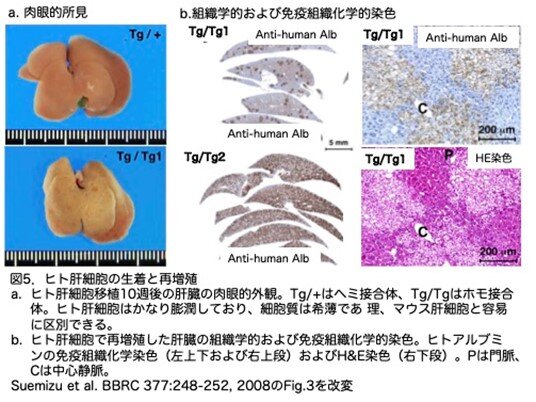
(3)移植後の肝臓の肉眼的および組織学的所見
ヒト肝細胞の移植後、ヘミ接合体およびホモ接合体のいずれの肝臓においても、肉眼的には色などの明らかな違いがないため、移植したヒト肝細胞の増殖は肉眼的検査では検出できませんでした(図5a)。組織学的には、ホモ接合体では、ヒト肝細胞はかなり膨潤しており、細胞質は希薄でしたので、これらの細胞はマウス肝細胞と容易に識別できました(図5b右下)。過ヨウ素酸シッフ(PAS)反応により、これらの細胞内の空隙がグリコーゲン貯蔵領域に相当することが示されました(データなし)。さらに、細胞質には小片や 小さな塊が見られ、過剰なグリコーゲンの蓄積によって細胞小器官が移動していることが示されました(データなし)。
血中ヒトAlb濃度は1.8 mg/ml のTg/Tg1では、再増殖指数は20%と推定されました(図5b、左上・右上)。また、ヒトAlb濃度が6.5 mg/ml のTg/Tg2では、肝細胞の約80%がヒトAlb陽性染色を示しました(図5b左下)。したがって、移植したホモ接合体の肝臓では、ヒト肝細胞巣の数と、ヒト肝細胞/全肝細胞数に基づいて算出した再増殖指数は、ヒトAlbの血中濃度測定値と対応しているようです。
最後に、これらの肝臓ヒト化NOG:Alb-Plauマウスは、薬物代謝、肝移植後の一般的な代謝作用、幹細胞の肝細胞への分化の研究に有用であると期待しているという文章で締めくくられています。
次はまた別の新たなレシピエントマウスの開発です
今回の論文では、NOG-Tg(Alb-Plau)が、従来のTg(Alb-Pau)と異なり、Alb-Plau遺伝子数がヘミ接合体で3コピー、ホモ接合体でも6コピーと少なく、死亡は殆どなく系統維持に問題はない事が示されました。また、一旦組込まれたAlb-Plau遺伝子のコピーが減少することもありませんでした。このコピー数の減少は、組込まれた染色体状の位置と関連しており、このような場合は違う系統を調べれば最適の系統を見つける事ができることを示唆しています。これらのことは肝臓ヒト化マウスを作製する上で効率が格段に良くなることが示唆され大きな進歩と思います。今回の論文では、肝臓ヒト化マウスの作製に利用できることは示されましたが、移植数が少なく、血清ヒトAlbがまだ十分高くなく、従来モデルよりも優れているかどうかは今後の課題として残りました。次回は、マウス肝細胞を死滅させるための新しい系を開発した論文(Hasegawa et al. The reconstituted 'humanized liver' in TK-NOG mice is mature and functional. Biochem. Biophys. Res. Commun. 405:405-,- 410,2011)を紹介したいと思います。