肝臓ヒト化マウスの歴史 第10話
株式会社トランスジェニック 顧問 山村研一
新たなレシピエントマウスの開発
前回の論文では、ヒト肝細胞を移植後にhGHを投与すると、GHRおよびhIGF1-hIGFRのシグナル伝達が活性化され、ヒト肝細胞の増殖亢進、置換率が上昇すること、血中hAlb値が増加すること、hGHは若いドナーの肝細胞の方がより大きな効果が期待できることが示されました。今までのレシピエントマウスはuPAが肝臓で発現しマウス肝細胞が死滅する系でした。このレシピエントマウスの欠点は、出血のため60-70%が死亡するという飼育効率の悪さ、移植可能な時期が生後5日から30日の間に限られること、uPA遺伝子の欠失によりマウス肝細胞が復活すること、腎疾患の発症などがあり、これらを克服したいというのが目的となります。このため、今回は、肝臓で発現しているFah (Fumarylacetoacetate hydrolase)を欠損させ肝細胞を死滅させる系で、かつ免疫寛容にするため今までとは違う系を用いた新しいレシピエントマウス「Fah-/-:Rag2-/-:Il2rg-/-(FRGと略)」(Azuma et al. Robust expansion of human hepatocytes in Fah-/-/Rag2-/-/Il2rg-/- mice. Nat. Biotechnol. 25:903-916, 2007)の論文を紹介したいと思います。
今回の着目点はちょっと多いのですが9つもあります。
第1は新しいレシピエントマウスとして「FRG」を用いています。この中のFah欠損がマウス肝細胞を死滅させる系ですが、まずこの論文では書かれていませんが、補足として「Fah-/-」マウスでの肝細胞死のメカニズムについて説明します。第2は免疫寛容とするための「Rag2-/-:Il2rg-/-」の特徴について説明します。第3は、肝臓ヒト化マウスの作製法です。Tg(Alb-uPA)マウスと違い、Fah-/-マウスは何もしないと出生後12時間以内に死亡しますので、肝臓ヒト化マウスの作製には工夫が必要でその方法を紹介します。第4は、ヒト肝細胞の生着率と置換率です。第5は、この新しい方法で作製した肝臓ヒト化マウスの肝臓はきちんと構築され機能は正常かどうかです。第6は、コラム第8話で述べられた腎臓の病変の有無です。第7は、連続移植というもので、一旦作製した肝臓ヒト化マウスの肝臓からヒト肝細胞を取り出してそれを用いて肝臓ヒト化マウスを作製できるのかどうかです。これは初めての試みです。これができると高価なヒト肝細胞をその都度購入しなくても良くなり非常に有効な方法となります。第8は、移植したヒト肝細胞とマウス肝細胞が融合しているかどうかの検証です。もしそうであればこの融合した細胞が見かけ上の「肝細胞再増殖」の理由となり肝臓ヒト化マウスではなくなってしまい、重要な検証項目です。第9は、これまでもTg(Alb-uPA)では解析されていますが薬物代謝のデータです。新たなレシピエントマウスでは何が影響するかわかりませんので必要なデータということになります(特にNature Biotechnologyのようないいジャーナルでは要求されることが多いです)。第10は、FRGマウスの利点です。それでは順番に結果を見ていきましょう。
1.「Fah-/-」マウスの特徴
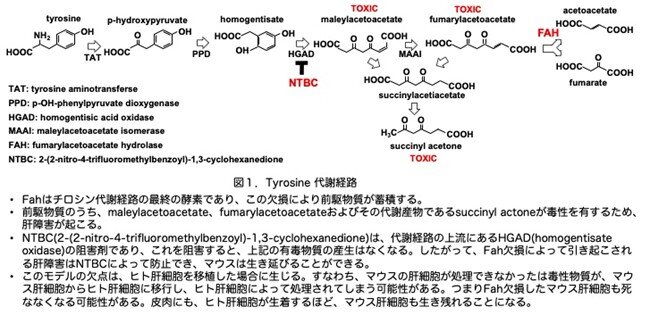
Fahはヒトの遺伝性チロシン血症I型の原因遺伝子で、これを欠損する患者は肝不全、腎障害、心筋障害が起こり1年以内に死亡することが知られています。マウスでもこのFah遺伝子を破壊することにより同様の症状が出ることが確認されています(Grompe et al. Genes Dev. 7:2298, 1993)。Fahはチロシン代謝経路の最終の酵素であり、この欠損により前駆物質が蓄積します(図1)。前駆物質のうち、maleylacetoacetate、fumarylacetoacetateおよびその代謝産物であるsuccinyl acetoneが毒性を有するため、肝障害が起こります。また、ヒトのチロシン血症I型の治療薬としてNTBC(2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione)(商品名Nitisinone)が1991年に使用が開始され、Fah欠損マウスでも有効であることが示されています(Grompe et al. Nat. Genet. 10:453-460, 1995)。つまりNTBCは、代謝経路の上流にあるHGAD(homogentisate oxidase)の阻害剤であり、これを阻害すると、上記の有毒物質の産生はなくなります。したがって、Fah欠損によって引き起こされる肝障害はNTBCによって防止でき、マウスは生存することができます。ただ、NTBCをずっと投与しておく必要がありますが、それ離脱するとマウス肝細胞が死に始めますが、この離脱時の投与の匙加減が難しいのが欠点です。このFahが関与するチロシンの代謝経路とNTBCの作用部位を図1に示します。
2.「Rag2-/-:Il2rg-/-」の特徴
結果の最初に以下のような興味ある記述が書かれていました。筆者らは当初、Fah-/-とヌード(Foxn1nu/nu)、NOD:SCID(PrkdcSCID/SCID )あるいはRag1 -/- との交配により、①Fah-/-: Foxn1nu/nu、②Fah-/-:NOD:SCID(PrkdcSCID/SCID )および③Fah-/-:Rag1-/-変異マウスを作製しています。しかし、①Fah-/-:Foxn1nu/nuおよび③Fah-/-:Rag1-/-では、ヒト肝細胞の生着は見られなかったようです。一方、②Fah-/-:Nod:PrkdcSCID/SCIDマウスでは、時折ヒト細胞が生着したようです。しかし、これらのマウスのほとんどは急速に肝不全を発症し、NTBCの投与中止後に死亡しています。おそらくPrkdcSCID/SCIDマウスに見られるDNA修復不全が原因であろうと書かれていますが、③の説明はありません。そこで筆者らは、T細胞、B細胞、ナチュラルキラー細胞を完全に欠失し、DNA修復欠損のない免疫不全Fah -/-マウスの作製を試みたようです。このため、ヒト造血異種移植片の優れたレシピエントであることが報告(Traggiai, E. et al. Science 304:104-107, 2004; Gorantla, S. et al. J. Virol. 81:2700-2712, 2007)されている「Rag2 -/- :IL2rg -/-」とFah-/-を交配し、「Fah-/-:Rag2-/-:Il2rg-/-」(FRGと略)三重変異体を作製しています。さて、今までのコラムで紹介してきた免疫寛容マウスを思い出して欲しいのですが、それらの特徴を表1にまとめました。第5話で紹介した論文では、「Tg(Alb-uPA):Foxn1nu/nu」ですのでヌードマウスを用いていますが、ラット肝細胞は生着しています。第6話では「Tg(Alb-uPA):Rag2-/-」で、Fah-/-:Rag1-/-とほぼ同じと思いますが、生着しています。第7話から第9話では「Tg(Alb-uPA):PrkdcSCID/SCID」でヒト肝細胞は生着しています。しかし、前述したようにこの論文ではNODも入れ、より免疫寛容にしたFah-/-:Nod: PrkdcSCID/SCIDマウスを用いた移植実験も行っていますが生着が悪いとのことです。要するに他の報告と比較するとこの論文での生着は概して悪いようです。理由は不明ですが、Fah欠損ではマウス肝細胞の死滅する速度が速いことと、肝細胞の増殖に適した環境が整えられていないせいかもしれません。一般的に免疫寛容状態が高いほど異種移植効率は高いと言われていますので、このことと関連するかもしれません。

3.肝臓ヒト化マウスの作製法
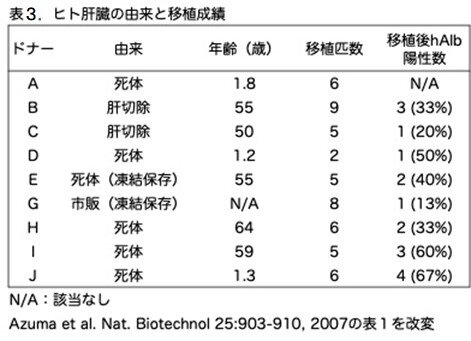
移植に用いられたヒト肝細胞は9人の異なるドナーから得られたもので、このうち7つのサンプルは脳死臓器提供者の肝臓から、2つは外科的肝切除から単離されたものでした。年齢等も気になりますのでリストを表2に示しておきます。なお、ヒト肝細胞の移植前にウロキナーゼ発現アデノウイルスをFRGマウスに投与することが有益かどうかをまず調べています。3回の移植で、ヒト肝細胞の一次生着を観察できたのは、最初にuPAアデノウイルスを投与されたレシピエントだけでした。そこで、その後の実験ではuPA前処置を行なっています。
手術が行われたピッツバーグ大学からヒト肝細胞の輸送連絡があり次第、FRGマウス(6-15週齢)にuPAウイルス(5x109プラーク形成単位(pfu)/マウス)を静脈注射(後眼窩)しています。輸送された肝細胞は、到着後直ちに(分離後24-48時間)で移植されています。

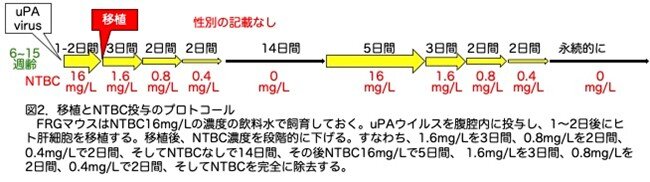
FRGマウスは、飲料水にNTBCを継続的に与えると、よく成長し、完全に受胎可能でした。従来のFah欠損単独マウスと同様に、FRGマウスでNTBCを中止すると、徐々に肝細胞障害が起こり、4-8週間後に最終的に死亡しています。ヒト肝細胞の移植は次の手順で行います。(1)FRGマウスはNTBC16mg/Lの濃度の飲料水で飼育しておき、(2)uPAウイルスを腹腔内に投与し、(3)1〜2日後にヒト肝細胞を移植し、(4)移植後、NTBC濃度を段階的に下げます。すなわち、1.6mg/Lを3日間、0.8mg/Lを2日間、0.4mg/Lで2日間、そしてNTBCを除去して14日間、その後NTBC16mg/Lで5日間、 1.6mg/Lを3日間、0.8mg/Lを2日間、0.4mg/Lで2日間、そしてNTBCを永続的に除去します。分かりにくいのでプロトコールを図2にまとめました。
4.ヒト肝細胞の生着率と置換率
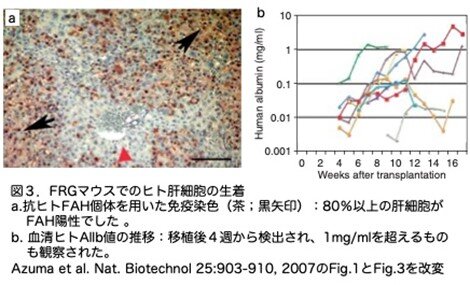
すべての実験において、使用した細胞バッチにかかわらず、少なくとも1匹のFRGにヒト肝細胞が明らかに生着したようです(表3)。移植片の生着は、組織学、DNA分析、酵素アッセイ、ヒト血清アルブミン(hAlb)濃度など、さまざまな方法で証明していますが、抗ヒトFAH抗体を用いた免疫染色(茶;黒矢印)では、80%以上の肝細胞がFAH陽性でした(図3a)。赤矢印はFAH陰性細胞を示しています。hAlb濃度によってモニターできた移植では、移植後4週目から10週目の間に初めて検出され、その後さらに数週間にわたって着実に増加し、43例の一次レシピエントのうち17例(39.5%;範囲12-67%)で生着が確認できました。このうち7匹は高度に再増殖し(30-90%)、hAlb濃度は1mg/mlを超えていました(本文中にはこの記述がありますが図3aを見ると17匹のデータはなく、5匹(緑、紫、黄色、青、赤)しか1mg/mlを超えていませんし(図3b)、この記述を裏付けるデータはどこにもありませんでした)。重要なことは、死体肝だけでなく肝切除肝からも、さらに、凍結保存した2つのヒト肝細胞もFRGマウスでも生着したことです(これはTg(uPA)ではすでに報告されています)。
5.肝臓ヒト化FRGマウスの肝臓の構造と機能
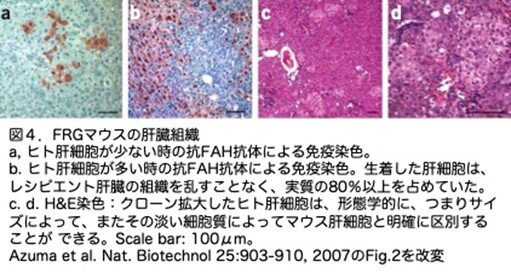
肝臓ヒト化FRGマウスの肝臓の組織構造を抗ヒトFAH抗体を用いた免疫染色とH&E染色で解析しています。FAH陽性ヒト肝細胞は、マウス肝臓の構造に完全に組み込まれたように見えました(図4a-d)。いくつかの肝臓ヒト化FRGマウスでは、生着したヒト肝細胞は、マウス肝臓の組織を乱すことなく、実質の80%以上を占めていました(図4b)。H&E染色により、クローン拡大したヒト肝細胞は、形態学的に、つまりサイズによって、またその淡い細胞質によってマウス肝細胞と明確に区別することができました(図4c,d)。また、ヒト肝細胞クラスターは好酸球が少ないため、周囲のマウス細胞よりも淡く見えます。したがって肝臓ヒト化FRGマウスの肝臓の構造と機能は正常と思われます。他の肝臓ヒト化マウスの論文でも、光学顕微鏡と免疫染色の結果から同じことが言われていますが、これだけで本当にいいのか、電子顕微鏡による解析でより微細な解析しなくていいのかが気になるところです。
6.腎臓の病変の有無
コラム第8話で紹介した論文(Tateno et al. Am. J. Pathol. 165:901-912, 2004)では、血清hAlb値が3mg/mlを超えるとヒト補体により腎障害が起こる、よってそれを防ぐためFuthanを投与することで高置換率の肝臓ヒト化マウスを得ることができたと書かれていました。この論文では、これを検証するため、3匹の高度置換率マウスをNTBC投与中止後4ヶ月間観察しています。しかし、体重と一般的な健康状態は正常であり、摘出時の腎臓は肉眼的にも組織学的にも正常であったと記載され、腎障害は観察されていません。また、第9話で紹介した論文は、第8話と同じグループからですが、ここでも高置換率の肝臓ヒト化マウスが得られていますが、腎障害については述べられていません。理由は不明ですが、ひょっとすると腎障害は用いた系統のせいかもしれません。例えば、Tensin2変異マウスではヒトに類似した慢性腎臓病が報告されています。このTensin2変異による腎臓病は興味深いことにマウスの系統により病態が大きく異なります。例えばFVBマウスにTensin2変異を導入すると腎症が引き起こされますが、C57BL/6マウスにTensin2変異を導入しても腎症はほとんど見られません。つまりC57BL/6マウスは腎症に対する抵抗性因子を持っていると考えられています。
7.連続移植
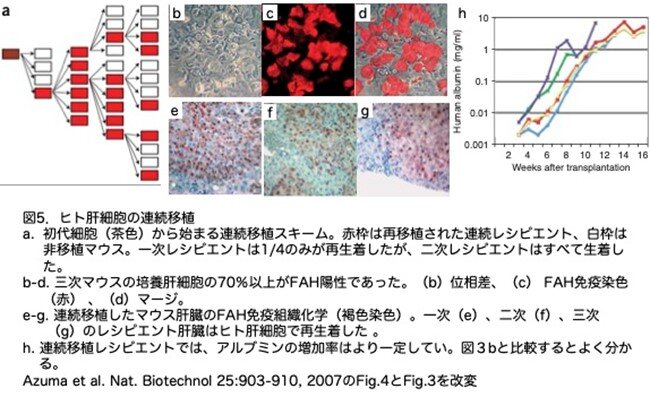
現在の肝臓異種移植モデルの限界の一つは、移植したヒト肝細胞をさらに増殖させることができないことです。肝臓ヒト化FRGマウス系における連続移植とは、最初に作製した肝臓ヒト化FRGマウスの肝臓からヒト肝細胞を回収し、次の新たなFRGマウスに移植する方法です。この可能性を検証するため、高度にヒト肝細胞が再増殖した一次レシピエントの肝臓をコラゲナーゼで灌流し、FAH陽性ヒト肝細胞とFAH陰性マウス肝細胞を分離することなく、100万個の生存肝細胞を二次FRGマウスに移植しました。一次移植に用いた細胞とは対照的に、この方法で採取したヒト肝細胞の生存率は80%以上であり、コラーゲンでコートした培養プレートに容易に接着しました(図5b-d)。ヒト肝細胞の再生着では、ヒト肝細胞は各世代で形態学的に類似しており、FAHに対する免疫染色によっても確認されました(図5f-h)。高度に再生着したマウスの割合は、連続移植FRGで高く(17/28対7/43)(図3bと図5hを比較、ただし分母および分子の数は示されていません)、hAlbの増加率はより一定していました(図3bと図5hを比較)。このことは、連続継代により移植可能なヒト肝細胞が濃縮されているのかもしれませんし、単にドナーマウスから新鮮に採取された細胞の品質と生存率が高いことを反映しているのかもしれません。
8.移植したヒト肝細胞とマウス肝細胞との融合の検証
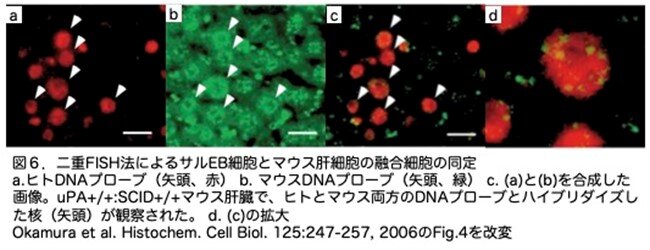
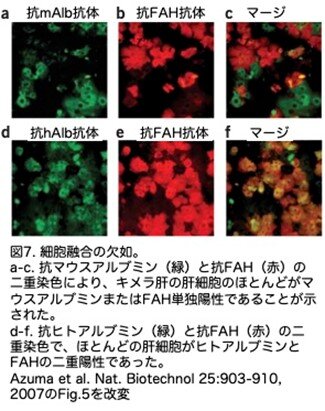
Okamuraらの論文(Okamura, K. et al. Histochem. Cell Biol. 125: 247-257, 2006)では、移植幹細胞と宿主幹細胞の細胞融合が見かけ上の「肝細胞再増殖」を説明できる可能性があることが示されました。具体的な内容は次のとおりです。まず霊長類であるカニクイザルのES細胞の培養によりembryoid body (EB)を形成させ、肝臓で発現する遺伝子が確かに発現していることを確認しています。そのEBをAlb-uPA(+/-):PrkdcSCID/SCIDに移植して肝臓サル化マウスを作製しています。その肝臓を解析しヒトDNA(サルDNAも検出できます)とマウスpan-centromeric probes(マウス特異的です)を用いてFISH(Fluorescence in-situ hybridization)解析を行いサルのEB細胞(最後はDAB: 3,3'Diaminobenzidineで発色するので茶褐色に染まります)とマウス肝細胞(FITC: Fluoresceinisothiocyanate isomer-Iでラベルされ緑に染まります)が融合している(同時に染色しておらずそれぞれの画像を重ねることで両方の色が見える細胞があることで判定)ことを示しました(図6)。そこでこの肝臓ヒト化FRGマウスでも融合が起こっているかどうかを検証するため、ヒトまたはマウス特異的アルブミンとFAHに対する二重免疫染色を行っています。ほとんどの(95%以上)マウスアルブミン陽性肝細胞は確かにFAH陰性であり(マウスの肝細胞はFah遺伝子がノックアウトされていますのでFAHは陰性です)、ほとんどのFAH陽性肝細胞はマウスアルブミン陰性でした(図7a-c)。一方、ヒトアルブミン陽性肝細胞はほとんどすべて(90%以上)がFAH陽性でしたが、残りの肝細胞は二重陰性でした(図7d-f)。細胞融合がないことをさらに確認するため、フローサイトメトリーでヒトとマウスの抗主要組織適合複合体抗原を解析しています。高度に再増殖した肝臓では、両種の表面マーカーに陽性の肝細胞は見つりませんでした(論文ではFig. 5g-jですが、ここでは省略します)。以上を総合すると、融合現象が起こったとしてもまれであり、連続移植を行った場合でも、増殖した肝細胞の大部分は純粋にヒト由来であったことがわかります。
9.薬物代謝
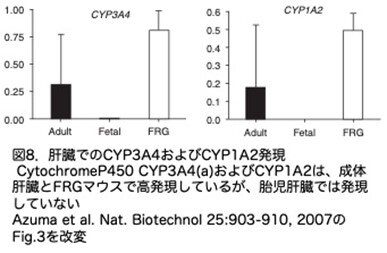
生着したヒト肝細胞の成熟状態を評価するために、肝臓ヒト化FRGマウスにおけるヒト肝臓特異的遺伝子の基礎発現と誘導を調べています。薬物代謝に重要な遺伝子(CYP1A2、CYP3A4)の発現を定量的RT-PCR法を用いて、ヒト成体肝細胞、ヒト胎児肝細胞、肝臓ヒト化FRG肝臓からの肝細胞(FRG肝細胞)での遺伝子発現レベルを比較したところ、FRGでの発現レベルは、ヒト成体肝臓によく一致し、胎児肝臓とは異なっていました(図8)。
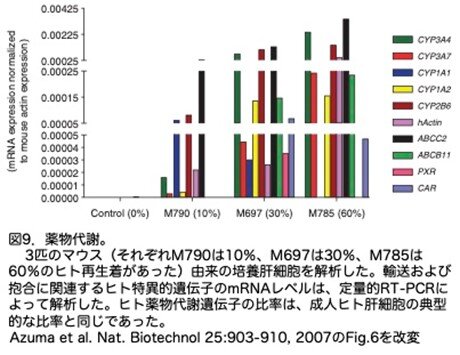
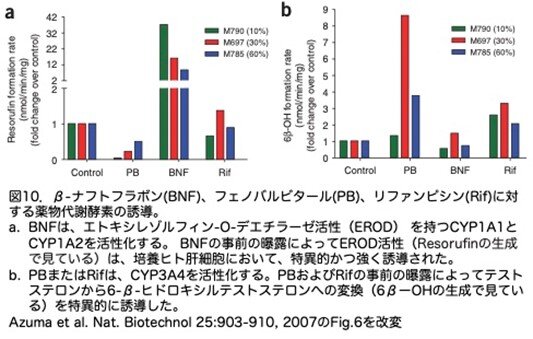
薬物検査における細胞の有用性をさらに検証するため、単離肝細胞の培養を確立し、チトクロームP450遺伝子のプロトタイプ誘導剤で処理しmRNA発現レベルを解析しました。まず誘導前の基礎遺伝子発現レベルですが、チトクローム(CYP1A1、CYP1A2、CYP2B6、CYP3A4、CYP3A7)、トランスポーター(ABCB11(旧名BSEP)、ABCC2(旧名MRP2))および薬物抱合酵素(UGT1A1)などの発現レベルは、FRG肝細胞の活性は、培養した正常成人ヒト肝細胞に見られるものと同等でした(図9)。さらにヒトCYP1Aおよび3Aファミリーの酵素活性を測定しました。エトキシレゾルフィン-O-デエチラーゼ活性(EROD)は、ヒト肝臓ではCYP1A1とCYP1A2によることが知られています。EROD活性は、FRG肝細胞において、BNF(β-ナフトフラボン)への事前の曝露によって特異的かつ強固に誘導されました(図10a)。また、フェノバルビタールまたはリファンピシンへによる事前の処理は、テストステロンの6-β-ヒドロキシルテストステロンへの変換を特異的に誘導しました(図10b)。このように、生着FRG肝細胞は、これらの標準的な薬物代謝アッセイにおいて、正常なヒト成人肝細胞と区別がつきませんでした。
10.薬物代謝
これまでの研究に用いられたTg(Alb-uPA)マウスには、冒頭に記載しましたが、実用上いくつかの大きな限界があります。それに対して肝臓ヒト化FRGマウスは、いくつかの点でTg(Alb-uPA)モデルより優れています。第1に、NTBCを投与している限り容易に飼育交配ができます。第2に、肝疾患の程度は、NTBCの投与と中止によってコントロールでき、年齢に関係なくいつでもヒト肝細胞を移植できます。第3に、Fah欠損変異は内在性Fah遺伝子の欠失であり、野生型に戻る可能性は稀です。したがって、Fahノックアウト肝臓では、内因性の復帰マウス細胞との競合は存在しません。第4に、マウス肝細胞の復帰がないということは、連続移植が可能であることを意味します。これはこの新しいシステムの大きな利点です。なぜなら連続移植によって、同じ遺伝子型のヒト細胞を何世代ものレシピエントマウスに拡大することができるからです。ここでは、4回の移植が可能であることを証明しました。10%の生着効率(10万個の細胞)と、置換後の最終的なヒト肝細胞約1,500万個であると見積もると、各ラウンドで少なくとも150倍の肝細胞を得ることができます。したがって、総増殖肝細胞数は少なくとも1504=5億倍になります。第5に、補体阻害剤を投与しなくても、肝臓ヒト化FRGマウスでは高い置換率の肝臓ヒト化マウスを得ることができます。ただ、これは「6.腎臓病変の有無」のところで記載しましたように、その後あまり問題になっておらず、FRGマウスの利点とはいえないかもしれません。第7に、品質が非常に多様で、あらゆる年齢のドナーのヒト肝細胞調製物を用いて、生着と肝臓の再増殖を達成することができています。ここで用いた細胞はすべて、移植の少なくとも24時間前に単離され、郵送されました。この遅れにもかかわらず、全てのバッチから一次生着が得られました。再増殖は若い死体ドナーに限らず、肝切除標本や凍結保存標本からも可能でした。最高齢のドナーは64歳でした。これらの所見は、FRG異種再増殖モデルの堅実性を示すものであり、新鮮な単離ヒト肝細胞を入手できない学術的・商業的研究室を含む様々な環境において有用であることを示唆しています。もっとも、この利点も置換率80%以上を目指すことを現在の目標からすると利点とは言えないようです。ですが、総合的に見ると肝臓ヒト化FRGマウスは優れているように思います。
次はまた別の新たなレシピエントマウスの開発です
今回の論文では、FRGマウスでは利点も多く、効率よく肝臓ヒト化マウスを作製できることが示されました。次回は、別の新たなレシピエントマウスで、マウスの中では最も免疫寛容となっているNOG (NOD:PrkdcSCID/SCID;IL2rg-/-)マウスの論文(Suemizu et al. Biochem. Biophys. Res. Commun. 377:248-252, 2008)を紹介したいと思います。