肝臓ヒト化マウスの歴史 第14話
株式会社トランスジェニック 顧問 山村研一
本コラムでは、多能性幹細胞であるヒトESあるいはiPS細胞から分化誘導したhepatocyte-like cell(肝細胞様細胞)を用いての肝臓ヒト化マウス作製の話で、「Si-Tayeb et al. Highly Efficient Generation of Human Hepatocyte-Like Cells from Induced Pluripotent Stem Cells. Hepatology 51 297 2010」の紹介です。
1.研究目的
Klf4(1-4)やNanog、Lin28といった初期化因子に加え、Oct3/4とSox2を強制発現させることで、体細胞から人工多能性幹(iPS)細胞を作製することができます。患者のiPS細胞から誘導される分化細胞は、組織置換や遺伝子治療への利用など、多くの治療応用の可能性を秘めています。iPS細胞を用いた細胞治療の利用は今後の長期目標となりますが、特定の細胞系譜への効率的な分化を促進するプロトコールが開発されれば、iPS由来の細胞は、疾患メカニズムの解析や医薬品の同定・研究に直ちに利用できるようになります。iPS細胞から肝細胞を作ることは、特に魅力的な目標です。この肝細胞は、先天性疾患と関連しているものもありますし、B型肝炎ウイルスやC型肝炎ウイルスなど、重篤な肝機能障害を引き起こす多くの病原体の標的であるため、iPS細胞からの肝細胞の樹立は大きな目標となります。さらに、他の多くの臓器とは異なり、肝実質への外来性肝細胞の導入は比較的簡単な操作であることから、肝臓はiPS細胞由来の肝細胞を用いた治療に非常に適していることが示唆されています。そこで著者らは、iPS細胞が胚において肝細胞の運命を辿ることができるかどうかを明らかにし、iPS細胞からヒト肝細胞様細胞を作製するための培養プロトコールを確立し、肝臓ヒト化マウスを作製することを目指しました。
2.方法論
ES細胞やiPS細胞の培養や樹立法、分化誘導法等ここでは必要ないかもしれませんが、結構大変であることを理解していただくため、概要を記載しておきます。
(1)ヒトES細胞
ヒトH9(WA09)ES細胞は、WiCell Research Institute - National Stem Cell Bank (http://www.wicell.org)から入手できるようです。ヒトH9(WA09)ES細胞は、低酸素条件下(4% O2/5%CO2)で huES 細胞培地(20%ノックアウト血清置換用試薬[Invitrogen]、非必須アミノ酸[Invitrogen]、グルタミン[Invitrogen]、ペニシリン/ストレプトマイシン[Invitrogen]、bFGF[4ng/ml、Invitrogen])を添加したDMEM F12培地)中で、有糸分裂ができないようにしたマウス胚性線維芽細胞(MEF)上で、あるいはMEF調整huES細胞培地を用いてマトリゲルコートプレート上で培養しています。
肝細胞への分化誘導は次のように行われています。アキュターゼ(ミリポア)を用いて採取した多能性細胞の単層を、2mg/mlのマトリゲル(Growth Factor Reduced; BD Bioscience)であらかじめコーティングした6ウェルプレート(Corning Costar #3516)に1ウェル当たり2.5x105細胞の密度でまき、低酸素条件下で、1週間培養しています。分化誘導は、100ng/ml Activin A(R&Dシステムズ)を含むRPMI/B27培地(Invitrogen)を用いて、20%O2/5%CO2下で5日間培養した後、20ng/ml BMP4(Peprotech)/10ng/ml FGF-2(Invitrogen)を含むRPMI/B27培地(Invitrogen)で、4% O2/5% CO2下で5日間培養することにより開始しました。その後、4%O2/5% CO2下で、20ng/ml HGF(Peprotech社製)を含むRPMI/B27培地で5日間、そして最後に、20% O2/5% CO2下で、20ng/ml Oncostatin-M(R&Dシステムズ社製)とSingle Quots(EGFなし)添加肝細胞培養培地(Lonza社製)で5日間培養しています。
(2)マウスiPS細胞の樹立
マウスiPS細胞は、Oct3/4、Sox2、Klf4を発現するレトロウイルスをマウス(C57BL/6J-Tg(pPGKneobpA)3Ems/J)胚線維芽細胞に感染させ、ES細胞に特徴的な形態を示すコロニーを採取することにより作製しています{Meissnerら、2007, Nat Biotechnol, 25, 1177-81; Takahashi and Yamanaka, 2006, Cell, 126, 663-76}。独立した2つの細胞株を樹立し、Oct3/4などの多能性細胞に特徴的なタンパク質の発現、アルカリホスファターゼ活性など、マウスR1 ES細胞と多くの特徴を共有していました。また、GATA4、α心筋ミオシン重鎖(αMHC、図示せず)、ミオシン軽鎖Mlc2v(Myl2)およびMlc2a(Myl7)、心筋αアクチン(Actc1)、トランスサイレチン(Ttr)、αフェトプロテイン(Afp)、ニューロDなど、分化細胞型に見られるタンパク質やmRNAは発現していませんでした。一方、懸濁培養で増殖させると、iPS細胞はR1 ES細胞と区別がつかない挙動、つまり嚢胞性胚様体(EB)を容易に形成し、これら全ての分化マーカーmRNAとミオシン重鎖(MHC)を発現していました。
(3)ヒトiPS(hiPS)細胞の樹立と培養
hiPS細胞は、Yuら{Yu et al. 2007, Science, 318, 1917-20}が確立したプロトコールに従って作製しています。簡単に説明すると、1x105個のヒト初代前皮線維芽細胞(CRL2097 ATCC)に、OCT4、SOX2、NANOGまたはLIN28を発現する濃縮した複製不能偽型レンチウイルスを感染させ、一晩のインキュベーション後、感染した細胞を、分裂不活性化マウス胚由来線維芽細胞を含む10cm2ディッシュ内に移しています。その後3-4週間かけて出現したコロニーを手作業で回収し、 mouse embryonic fibroblasts (MEFs)上で増殖させています。マウスiPS細胞は、Takahashiら(Takahashi and Yamanaka, 2006, Cell, 126, 663-76)の手順に従って作製しています。リプログラミング用レトロウイルスはPLAT-E細胞で作製し、トランスフェクション後48時間で、ウイルスを含む上清を回収、ろ過し、セントリコンプラス-70遠心ろ過装置(ミリポア社製)を用いて濃縮しています。前日に100mmディッシュあたり8×105細胞で播種したMEFをウイルス濃縮液で感染させ、一晩培養した後、その培養上清を有糸分裂ができなくしたMEFを含む100mmディッシュに移しました。 培養20日後、顕微鏡でES様形態を示すコロニーが100個ほど確認できました。その後、約12個のES細胞様コロニーを手作業で収集し、最適な形態を持つ3-4個をクローン展開して、さらなる解析に用いています。
iPS細胞もES細胞と同じ条件で培養および分化誘導しています。
(4)レーザーキャプチャーマイクロダイセクション分析
耳慣れない方法かもしれませんので説明しておきます。パラフィン切片から約300~400個の核をレーザーパルス捕捉法(Zeiss P.A.L.M Microbeam II)で採取し、溶解バッファー(NaOH 0.01M, EDTA 0.5M in H2O)に回収しています。サンプルを95℃で30分間インキュベートし、ヒトAlu反復配列(aatggcccaactgcagaa; catcgcattcacatccaa、産物=182bp)またはマウスヒポキサンチン-グアニンホスホリボシルトランスフェラーゼ(HPRT)配列(agcgcaagttgaatctgc, agcgacaatctaccagag、産物=219bp)のオリゴヌクレオチドを用いたPCRでゲノムDNAを増幅しています。
(5)その他の方法
免疫組織染色、過ヨウ素酸シッフ染色、低比重リポ蛋白(LDL)とインドシアニングリーンの取り込み、オイルレッドO染色、アルブミン分泌、オリゴヌクレオチドアレイとRT-PCR解析、アルカリホスファターゼ活性、については省略します。
3.補足:iPS細胞樹立に必要な因子の同定(論文には書かれていません
本論文は、ES細胞およびiPS細胞から肝細胞を誘導し、肝臓ヒト化マウスを作製した論文です。iPSの樹立法についてはネットでも検索すれば分かりやすい説明を見つけることができます。しかし、iPS樹立に必要な山中4因子がどのように発見したかについて興味のある方もおられると思いますので、それが記載された最初の論文「Takahashi, K. & Yamanaka, Cell 126: 663-676, 2006」について簡単に説明しておきます。
体細胞に多能性を誘導する因子は、ES細胞の性質の維持においても極めて重要な役割を果たしているという仮説に基づき、その候補として24遺伝子を選択しています(表1)が、これの候補遺伝子の選別も過去の文献から検索するので大変だったと思います。
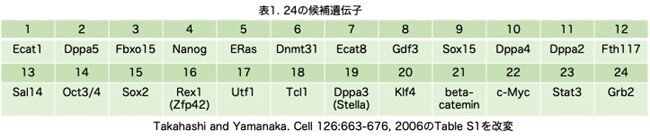
β-catenin、c-Myc、Stat3については、それぞれ活性型であるS33Y-β-catenin、T58A-c-Myc、Stat3-Cを用いています。多能性に対する負に働くGrb2については、そのドミナントネガティブ変異体Grb2ΔSH2を用いています。
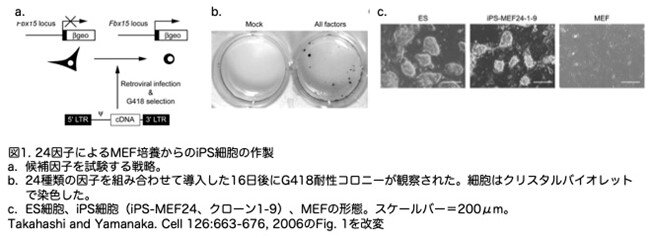
これらの24の候補遺伝子を評価するために、多能性状態の誘導をG418に対する耐性として検出できるアッセイ系を開発しています(図1a)。相同組換えにより、マウス Fbx15遺伝子にβgeoカセット(β-galactosidaseとneomycin―resistance遺伝子の融合)を挿入しました(Tokuzawaet al.)。Fbx15はマウスES細胞と初期胚で特異的に発現していますが、多能性の維持とマウスの発生には必要ありませんのでノックアウトしても問題ありません。βgeoノックインコンストラクトをホモ接合体に持つES細胞(Fbx15βgeo/βgeo)は、極めて高濃度のG418(12mg/mlまで)に抵抗性でしたが、Fbx15βgeo/βgeoマウス由来の体細胞は、通常の濃度のG418(0.3mg/ml)に感受性でした。
Fbx15βgeo/βgeo胚のマウス胚線維芽細胞(MEF)に、レトロウイルス導入により24の候補遺伝子を導入しました。形質転換された細胞は、G418(0.3mg/ml)を含むES細胞培地中で、STOフィーダー細胞上で培養しました。しかし、単一因子だけでは薬剤耐性コロニーは得られず、一つの候補遺伝子で十分ではないことが示されました。一方、24個の候補細胞すべてを一緒に導入すると、22個のG418耐性コロニーができました(図1b)。G418選抜下で培養を続けた12クローンのうち、5クローンは丸い形、大きな核小体、乏しい細胞質など、ES細胞に似た形態を示しました(図1c)。実験を繰り返し、29個のG418耐性コロニーを観察し、その中から6個のコロニーを選別しました。これらのクローンのうち4つは、ES細胞様の形態と増殖特性を有していました。これらの細胞の倍加時間(19.4、17.5、18.7、18.6時間)は、ES細胞(17.0時間)と同等でした。これらの細胞をiPS-MEF24と命名しました。逆転写PCR(RT-PCR)解析の結果、iPS-MEF24クローンは、Oct3/4、Nanog、E-Ras、Cripto、Dax1、Zfp296、Fgf4等のES細胞マーカーを発現していました。これらのデータは、24の候補因子の組み合わせが、MEFにES細胞マーカー遺伝子の発現を誘導することを示しています。この結果を見た研究者は、あとはこの24の候補遺伝子を絞り込めばいいわけですから、嬉しくて夜も眠れないほど興奮したと思います。
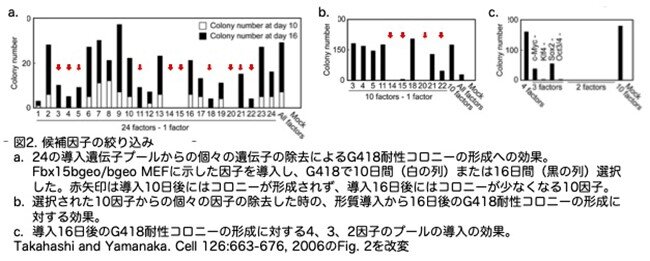
次に、24の候補のうちどれが重要かを決定するために、候補遺伝子のプールからの個々の遺伝子の除去の効果を調べました(図2a)。その結果、24遺伝子導入プールから個々の遺伝子を取り除くと、導入10日後にはコロニーが形成されず、導入16日後にはコロニーが少なくなる10因子(No. 3、4、5、11、14、15、18、20、21、22)が同定されました。これら10遺伝子を単独で組み合わせると、24遺伝子全てを導入するよりも多く のES細胞様コロニーが得られました(図2b)。
次に、MEFに導入した10因子プールから個々の遺伝子を除去した後のコロニーの形成を調べました(図2b)。Oct3/4(No.14)またはKlf4(No.20)を除去すると、G418耐性コロニーは形成されませんでした。Sox2 (No.15)を除去すると、G418抵抗性のコロニーはわずかしか形成されず、c-Myc(No. 22)を除去すると、G418抵抗性のコロニーが出現しましたが、これはより平坦で、ES細胞らしくない形態でした。残りの遺伝子を除去しても、コロニー数に有意な影響はありませんでした。
G418耐性コロニーの形成は、2つの因子の組み合わせでは誘導できませんでした(図2C)。3つの因子の組み合わせ「Oct3/4、Sox2、c-Myc(Klf4を除く)」、または「Klf4、Sox2、c-Myc(Oct3/4を除く))では、それぞれ単一の小さなコロニーを形成しましたが、これらは培養では維持できませんでした。「Oct3/4、Klf4、およびSox2(c-Mycを除く)」の組み合わせでは、36個のG418耐性コロニーの形成が観察されましたが、これらのコロニーは平坦で、非ES細胞様の形態を示ました。「Oct3/4、Klf4、およびc-Myc(Sox2を除く)」の組み合わせでは、54個のG418耐性コロニーの形成が観察され、そのうちの6個を選別しました。6個すべてのクローンは数継代にわたって維持することができましたが、これらの細胞(iPSMEF3)の形態は、iPS-MEF4およびiPS-MEF10細胞とは異なり、iPS-MEF3のコロニーは粗い表面を示しました。これらのデータは、Oct3/4、c-Myc、Klf4の組み合わせで誘導される変化は、iPS-MEF4細胞やiPS-MEF10細胞で見られるものとは異なります。上記の結果は、Oct3/4、Klf4、Sox2、およびc-Mycが、MEFからのiPS細胞の作製において重要な役割を果たしていることを示しています。
ということで、たった4つの遺伝子で体細胞が初期化され、多能性を持つに至ることが示されました。この結果には世界中が驚き、大きな衝撃を与えたといっても過言ではありません。山中先生によれば、当時は多くの研究者がES細胞のような幹細胞からどのように分化した細胞を誘導できるかについて取り組んでいたようです。この分野だととても勝ち目はない、よって逆の方向に取り組もうということで、体細胞から幹細胞を誘導しようと考えたのだそうです。誰も取り組もうとしなったということは、誰もそんなことができるとは思ってもみなかったということです。誰もやろうとしないことに挑戦するというのが本来の科学者の勤めのはずですが、そんなことできるはずがないという声の中それに挑戦するというは大変勇気のいることだったと思います。このことを書いているとES細胞を用いて最初に相同組換えを成功させノーベル賞を受賞したDr. Mario Capecchiを思いだされました。彼は何度もNIHに相同組換え実験で研究費を申請したそうですが、審査員からそれは不可能と言われずっと採択されない状況が続いたそうです。そしてようやく成功した時、審査員から諦めずにやってよかったねと言われたそうです。このように真の独創的な研究は、最初は誰からも理解されない、しかしそれを続けられる環境、つまり競争的資金によらない研究費が必要であることを強く示唆しています。ショウペンハウエルの有名な言葉があります。斬新な提案をすると「最初は無視される」、それでもめげずにやっていると「足を引っ張られる」、そしてうまく行くと「それは当たり前のことで私も同じことを考えていた」と言われるのだそうです。きっと山中先生も同じ目にあったのではないかと想像します。
4.ヒト化肝臓マウスからのPHHの単離
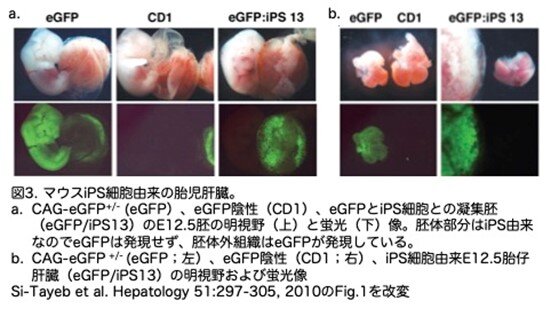
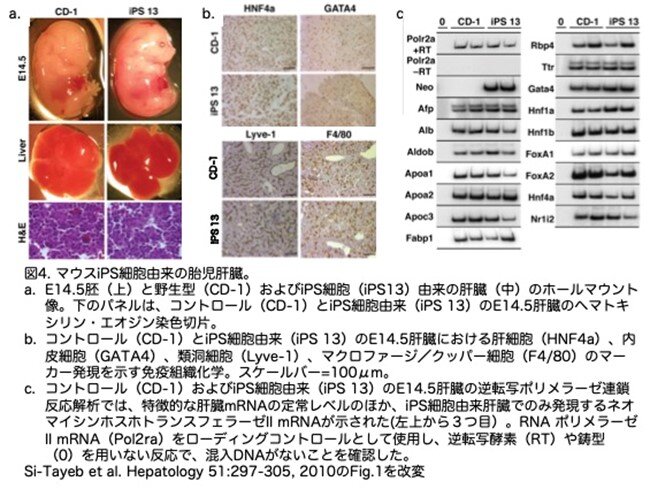
マウスiPS細胞は、C57BL/6J-Tg(pPGKneobpA)3Ems/J線維芽細胞から作製しています。 そして、増強型緑色蛍光タンパク質(EGFP)を全身的に発現するトランスジェニックマウス(Tg[CAG-EGFP]-B5Nagy/J)を四倍体胚のドナーとして用い、その胚とiPS細胞とで凝集胚を形成させました(ちなみに四倍体胚はマウスの2細胞期胚を電気融合して作製できます)。これらの凝集胚を仮親の子宮に移植すると着床し発生します。この時、四倍体の胚細胞は、胚体外組織にしかなれず、個体形成には参加できないため、種々の組織・臓器、例えば肝臓は全てiPS由来の細胞から形成されます。つまりiPS細胞がin vivoで肝臓に分化できるかを解析しています。図3aは、CAG-EGFP胚(四倍体胚にしていないのでEGFPは全身で発現)がEGFPを全身的に発現しているのに対し、野生型CD1胚ではEGFPを有しておらず検出されないことを示しています。EGFPが導入されていないマウスiPS細胞から胚を作製した場合、その肝臓を含むすべての胚(n=5)(図3b)は、ドナーの4倍体胚に由来する胚体外組織を除いて、EGFPの発現がありませんでした。写真が不鮮明で非常に分かりづらい図です。
E14.5のiPS細胞由来胚とその肝臓(n=3)を肉眼で観察したところ、コントロールと同じであることがわかりました(図4a)。そこで、特定の細胞タイプに特徴的なタンパク質の発現を解析することで、これらの肝臓内に存在すべき種々の細胞が含まれているかどうかを調べました。図4bは、コントロールのCD1胎児肝臓と同様に、iPS細胞由来の肝臓にも肝細胞(肝細胞核因子[HNF]4陽性)、内皮細胞(GATA結合タンパク質4[GATA4]陽性)、類洞細胞(リンパ管内皮ヒアルロン酸受容体1陽性)、およびクッパー細胞/マクロファージ(F4/80陽性)が含まれていることを示しています。また、肝細胞系の主要なマーカーであるメッセンジャーRNA(mRNA)を検出するために、逆転写ポリメラーゼ連鎖反応を用いて、肝細胞分化の程度を測定しました。図4cは、調べたすべての肝細胞マーカーmRNA(αフェトタンパク質、アルブミン、アルドラーゼb、アポリポタンパク質A1、A2、C2、肝脂肪酸結合タンパク質(Fabp1)、レチノール結合タンパク質(Rbp4)、トランスサイレチン)が、コントロールの胎児肝臓と同程度のレベルで発現していることを示しています。さらに、肝転写因子-Gata4、Hnf1a、Hnf1b、FoxA1、FoxA2、Pxr(Nr1i2)、Hnf4aをコードするいくつかのmRNAの発現は、コントロールの肝臓と同等のレベルでした。これらの結果を総合すると、マウスiPS細胞はin vivoで胎児の肝臓を作る能力が十分にあると結論づけられます。
5.ヒト胚性幹細胞(huES)からの肝細胞様細胞の作製
iPS細胞から臨床的・科学的に有用な肝細胞をin vitroで作製するためには、効率的で再現性のある肝細胞系への分化をサポートできる成分が明らかな培養条件を利用できることが必要です。ヒトES細胞やマウスES細胞の分化誘導に用いられている既存の方法は、一般に、培養では同定できない成分(例えば牛胎児血清)を含んでいます。これでは、この細胞を治療的に使用する場合、問題となる可能性があります。そこで著者らは、血清、線維芽細胞フィーダー細胞、胚様体、および明確でない培養液成分を使用しないことを目指しました。まずhuESを用いて分化誘導方法を最適化することを試みています。そこで、マウス胚発生の基礎となるメカニズムを理解し、他の研究者によって発表され利用可能なプロトコール(12-14)を調べ、そして経験的に知られている方法を使用することにより、胚体内胚葉(definitive endoderm)のマーカーを発現する細胞の増加をもたらすことができました。これらのマーカーには、フォークヘッドボックスA2(FOXA2)、 性決定領域Yボックス17(SOX17)、およびGATA結合タンパク質4(GATA4)、特定肝細胞(FOXA2およびHNF4a)、肝芽細胞(FOXA2、HNF4a、およびα-フェトプロテイン[AFP])、および分化肝細胞(FOXA2、HNF4a、およびアルブミン[ALB])が含まれます。
図5aに、著者らが用いた手順を示しました。未分化幹細胞は、4%O2/5%CO2の条件下で、有糸分裂を不活化した初代マウス胚線維芽細胞存在下でES細胞培養液を用いてマトリゲル上で単層培養を維持しています。この条件下で、95%以上の細胞が、Oct4(図5b)やステージ特異的胚抗原4(図なし)を含む多能性マーカーを発現しました。分化を開始するために、huES細胞の単層を、B27サプリメントと100 ng/mLのアクチビンAを含むRPMI(Roswell Park Memorial Institute)培地で培養しました。この培地は、胚体内胚葉の分化を効率的に誘導することが示されています。20%O2/5%CO2中で5日間培養すると、90%以上の細胞が多能性マーカーOCT3/4(図5b 2B)とステージ特異的胚性抗原4(図なし)の発現がなくなりました。胚体内胚葉で発現するタンパク質を検出する抗体を用いた免疫組織化学では、80%以上の細胞がFOXA2、GATA4、SOX17を発現していました。重要なことは、これらの細胞は、胚体外内胚葉細胞で高発現しているHNF4aを発現してなかったです。つまりアクチビンA処理によって臓側(卵黄嚢)内胚葉も誘導されますが、この場合はHNF4aを発現しますので、発現していないと言うことはこれから生じた内胚葉ではないことを確認することができました。
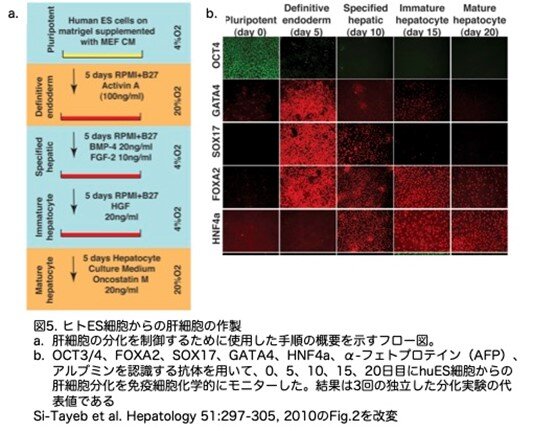
誘導された胚体内胚葉を含む細胞は、次に20ng/mLの骨形成タンパク質4(BMP4)と10ng/mLの線維芽細胞増殖因子2(FGF2)を添加したRPMI/B27培地中の4%O2/5%CO2に移し5日間培養しました。BMP4とFGF2はともに、マウス胚の肝臓への分化において重要な役割を果たすことが示されています。図5bは、BMP4/FGF2添加培地での培養により、GATA4とSOX17の両方の発現が減少し、一方でFOXA2の発現は維持され、HNF4aの発現は開始しました。この発現パターンは、マウスの肝臓発生時に見られるパターンに酷似しています。特に、GATA4の発現は、腸内胚葉では発現が維持されるのに対し、肝臓の運命をたどることになる細胞では特異的に発現は低下し、HNF4aの発現は肝臓への分化段階(10体節)で出現しようとしている肝細胞に限定されています。
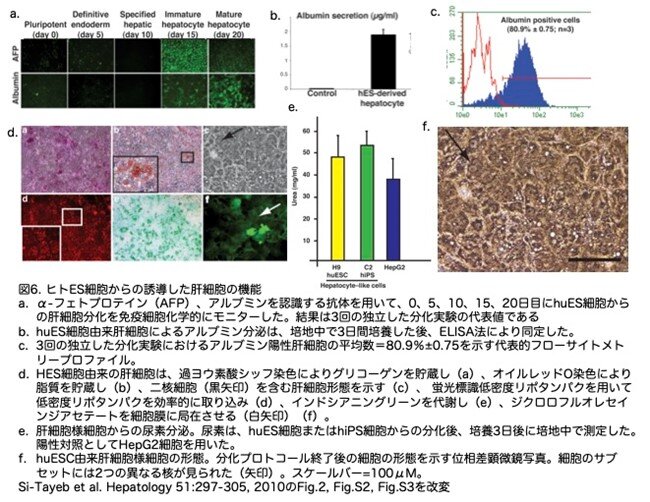
BMP4/FGF2添加後の肝細胞への分化傾向は強く、80%以上の細胞がHNF4aを発現しました。他の研究者の知見に基づき、私たちは肝細胞への方向性を示した細胞を肝細胞増殖因子20ng/mLを添加したRPMI-B27で、4%O2/5%CO2下で培養しました。肝細胞増殖因子を添加した培養条件では、α-フェトプロテインが高発現し、肝細胞への方向性を示した細胞が肝芽細胞運命にコミットしたことが示されました(図6a)。FoxA2との共染色(図なし)により、FoxA2発現細胞の98%以上がα-フェトプロテインを共発現していることが示され、内胚葉から肝臓系への分化が極めて効率的であることが示唆されました。分化の最終段階として、培養液皿を20%O2/5%CO2に移し、さらに5日間、オンコスタチンM(20ng/mL)を添加した肝細胞培養液に交換しました。この条件下で、細胞は高レベルのアルブミンを発現していることが判明しました。このアルブミンは、免疫組織化学によって同定し(図6a)、 ELISA(図6b)により培地中の濃度を定量しました。フローサイトメトリー分析によると、平均して80%の細胞がアルブミン陽性でした(図6c)。分化が完了した時点で、細胞はいくつかの既知の肝細胞機能を示すこともわかりました。過ヨウ素酸シッフ染色は、分化細胞によるグリコーゲン合成を示し、オイルレッドO染色は脂質滴の存在を示し、蛍光標識低密度リポ蛋白質とのインキュベーションは、細胞が低密度リポ蛋白質を蓄積する能力を示しました(図6d)。分化した細胞は上皮層を思わせるシートを形成し、ジクロロフルオレセインジアセテートを細胞膜に積極的に局在さ せることができていました(図6d、矢印)。培養液の解析から、細胞が尿素代謝を行う能力があることも明らかになりました(図6e)。分化細胞の形態も、細胞質と核の比率が大きく、多数の液胞や小胞があり、核小体が目立つなど、初代肝細胞と多くの特徴を共有していました。また、いくつかの細胞は二核でした(図6e)。
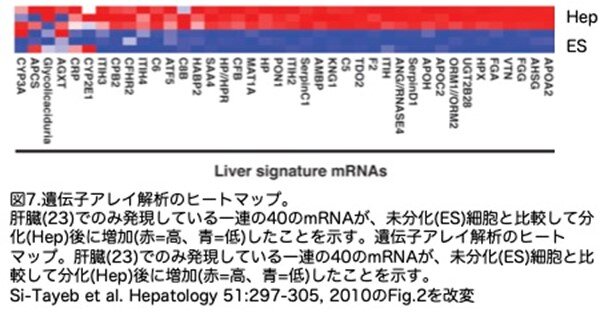
さらに、遺伝子アレイ解析を用いて分化の程度を調べました。この解析は、未分化のH9ES細胞と、20日間の完全な分化プロトコールに従って分化誘導した細胞を用いて、3回の独立した実験で行っています。他の研究者によるゲノムワイド発現プロファイリング研究では、他の35組織と比較して、正常ヒト肝臓で発現が認められる175遺伝子のクラスターが同定されています。これらの遺伝子のうち40個のサブセットは、他の研究で肝細胞の性状を同定するのに使用されており、これらの40個の遺伝子の発現が、分化した肝細胞の表現型を示す正確な転写フィンガープリントになると考えられています。予想されたように、この遺伝子群は未分化のhuES細胞では発現していません(図7)。しかし、ほぼ全遺伝子セットは、分化プロトコールの完了後に発現が強く増強しました。以上の解析結果から、我々は、分子が明確に規定された培養条件下で、huES細胞から効率的かつ再現性よく肝細胞様細胞を作製できるプロトコールを作成することができました。
6.ヒトiPS細胞の樹立
ヒト人工多能性幹細胞(hiPS)から、huES細胞を用いた場合と同様の効率で肝細胞を作製することができれば、ヒト肝疾患の研究や治療のための信頼性の高いツールとなるだけでなく、毒性研究や医薬品スクリーニングのためのヒト肝細胞を提供できる可能性があります。しかし、体細胞の核の初期化がiPS細胞からの肝細胞分化に及ぼす影響は不明でです。そこで筆者らは、Yuら(Yu et al. Science 2007;318:1917-1920)が記述したように、POU domain class 5転写因子1(OCT3/4)、SRY-box containing gene 2(SOX2)、NANOGホメオボックス(NANOG)、Lin-28ホモログ(LN28)を独立に発現するレンチウイルスを導入することにより、包皮線維芽細胞からhiPSを作製しました。
huES細胞に形態学的に類似した細胞のコロニーを選択し(図8a)、huES細胞の増殖に用いた条件と同じ条件で培養を維持しました。今後の研究のために、3つの独立したhiPS細胞株を選択しました、各系統は正常な核型を示し(図8b)、DNAフィンガープリント解析の結果、初期化のためのドナー体細胞として用いた包皮線維芽細胞と完全に一致したことから、これらの細胞がhuES細胞の混入物である可能性は除外されました。各株は、OCT3/4、SSEA4、アルカリホスファターゼ活性を含む多能性のマーカーを発現していることがわかりました(図8c)。私たちは、以下の研究のためにiPS.C2aという1つの株を選び、これらの細胞を真のhiPS細胞として確定するために、さらなる実験を行いました。Mikkelsenらは以前に、ヒト線維芽細胞をiPS細胞に初期化した後に発現が減少または増加した遺伝子のセットを明らかにしており、線維芽細胞からiPS細胞への移行の特徴的なプロフィールとなっています{Mikkelsen et al. 2008, Nature, 454, 49-55}。そこで、ヒト包皮線維芽細胞、ヒト(H9)ES細胞、iPS.C2a細胞の遺伝子アレイ解析を行い、これらの遺伝子セットの発現を調べました。図8dは、iPS.C2a細胞が包皮線維芽細胞とは異なる発現プロフィールを示し、huES細胞とはほとんど区別がつかないことを示しています。最後に、iPS.C2a細胞は、胚様体として培養することにより、あるいは免疫不全マウスの腎臓の皮膜下に注入して奇形腫を形成させ、3つの胚様(外胚葉、中胚様、内胚葉のこと)に由来する以下の細胞を同定することができました(図8d)(n、神経組織;s、脂腺組織;ce、円柱上皮;g、腸様上皮;sm、線条筋;b、血球;a、脂肪組織;ca、軟骨;ib、未成熟骨)。このiPS.C2aを用いてさらなる実験を行ないました。iPS細胞の特性を明らかにするための明確な基準はまだ確立されていませんが、上述の総合的な分析に基づき、iPS.C2a細胞は正真正銘のhiPS細胞であると結論付けています。
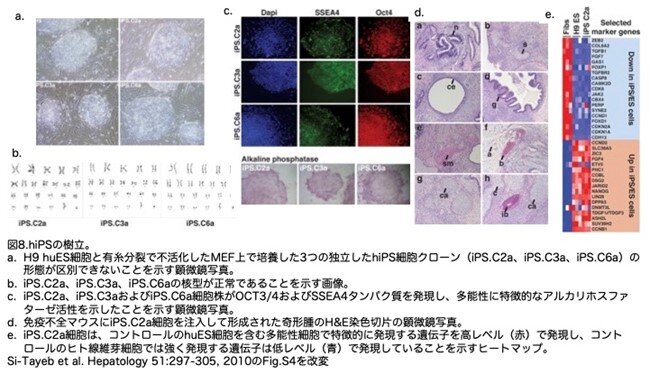
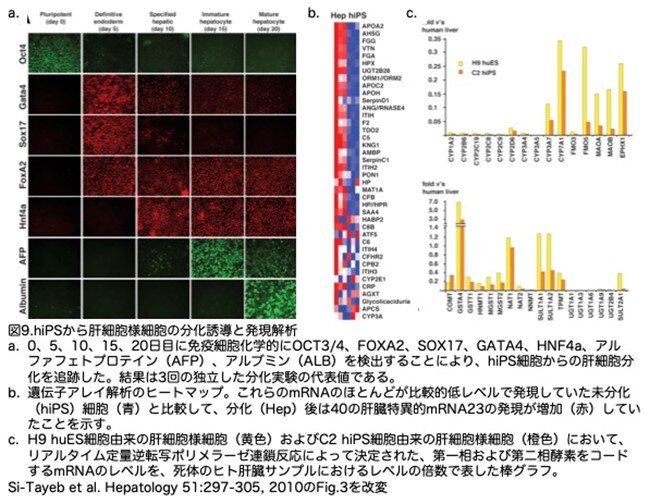
7.hiPSから肝細胞様細胞の分化誘導と発現解析
iPS.C2a細胞が肝細胞様細胞を形成する能力を調べました。huES細胞から肝細胞の形成を誘導したのと同じプロトコールで、ヒトiPS細胞から肝細胞様細胞を誘導し、同じ解析を行っています。huES細胞の場合と同様に、iPS細胞は誘導方法に反応し、アクチビンAに反応して胚体内胚葉のマーカーをすべて発現し、BMP4/FGF2に反応して肝特定化、肝細胞増殖因子に反応して肝芽細胞形成、オンコスタチンMに反応して肝細胞様分化を示しました(図9a)。アルブミンの定量から、肝分化の速度と効率は、huES細胞の分化に見られたものと同様であることが明らかになりました(図2A)。オリゴヌクレオチドアレイ解析により、iPS細胞由来の肝細胞様細胞は、ヒトES細胞由来の肝細胞様細胞で見出されたものと同じ肝細胞mRNAフィンガープリントを発現していることが明らかになりました(図9b)。また、完全に分化した肝細胞に特徴的な発現を示す第一相および第二相酵素をコードする一連の遺伝子の発現を、死体肝臓サンプルとhuES細胞またはhiPS細胞由来の肝細胞様細胞との間で比較しました。いずれの場合も、このようなmRNAの発現レベルは、同様の傾向を示しました。しかし注目すべきは、成人の肝臓サンプルと比較した場合、ほとんどのケースでこれらの酵素の発現レベルが低かったことです(図9c)。このことは、huES細胞あるいはhiPS細胞由来の肝細胞様細胞は、第1相および第2相酵素をコードする遺伝子の発現はあるものの、成熟肝機能を完全に再現しているわけではないことを示唆しています。
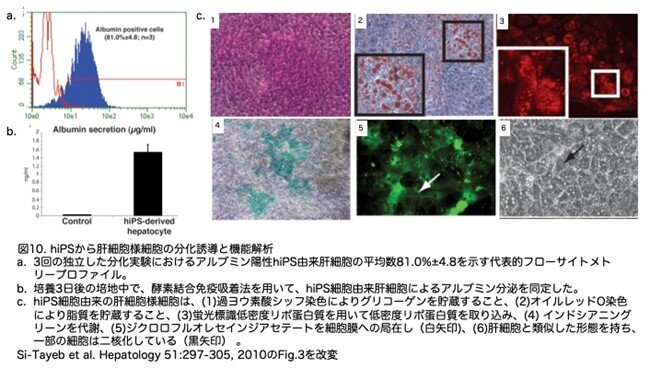
8.レンチウイルスベクターによるmpPHHへの遺伝子操作
フローサイトメトリーの結果、分化誘導終了時には、細胞の80%以上がアルブミンを発現しており(図10a)、培養3日後には培地中のヒトアルブミンレベルが1.5μg/mLに近づきました(図10b)。オリゴヌクレオチドアレイ解析により、iPS細胞由来の肝細胞様細胞は、ヒトES細胞由来の肝細胞様細胞で見出されたものと同じ肝細胞mRNAフィンガープリントを発現していることが明らかになりました(図9e)。ヒトES細胞由来の肝細胞様細胞と同様に、iPS細胞由来の肝細胞様細胞も、グリコーゲンの蓄積(図10c[1])、脂質の蓄積(図10c[2])、低密度リポタンパク質の積極的取り込み(図10c[3])、インドシアニングリーンの代謝(図10c[4])、ジクロロフルオレセインジアセテートを細胞膜に局在(白矢印)(図10c[5])尿素の合成など(図省略)、等の肝機能を示しました。また、hiPS細胞から作製された細胞は、肝細胞に関連する多くの形態学的特徴を示しました(図10c[6])。
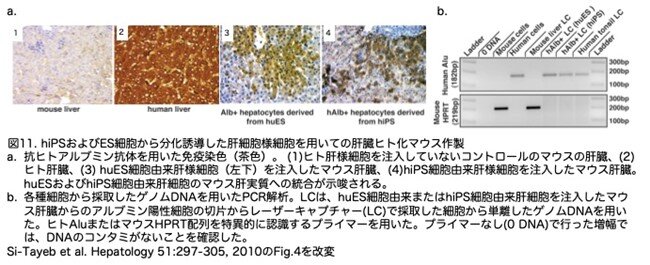
9.肝臓ヒト化マウスの作製
最後に、huES細胞とhiPS細胞から作製した分化肝細胞様細胞が、in vivoで肝実質に寄与する能力を持つかどうかを調べました(図11)。このため、20日間の分化プロトコルが終了した時点で細胞を回収し、約3x105個の細胞を新生マウスの右側肝葉に注入しました。注入7日後に肝臓を採取し、ヒトのアルブミンを特異的に認識する抗体を用いて免疫組織染色を行いました(図11a)。ヒト肝様細胞を注入していない対照マウスには、ヒトアルブミン陽性細胞は見られませんでした(図11a[1])。ヒト肝臓切片では、当然ですがヒトアルブミン陽性細胞が検出されました(図11a[2])。一方、huES細胞由来またはhiPS細胞由来の肝細胞様細胞を注射したマウスでは、注射した葉全体にヒトアルブミンを強く発現する細胞が認められました(図11a[3]および[4])。高解像度では、注射した小葉のヒトアルブミン陽性細胞は、既存のマウス実質に統合されていることが確認できました(図なし)。アルブミンは分泌タンパク質であるため、周囲のマウス細胞に取り込まれ、偽陽性を示す可能性があります。そこで我々は、レーザーキャプチャー・マイクロダイセクションで採取したヒトアルブミン陽性細胞から単離したゲノムDNAのポリメラーゼ連鎖反応を用いて、アルブミン陽性と検出された細胞が本当にヒト由来であることを確認しました(図11b)。これらの結果から、ヒト包皮線維芽細胞由来のhiPS細胞は、培養において効率的に肝細胞様細胞を形成するように誘導することができ、in vivoにおいて肝実質に統合する能力を内在していると結論付けられます。
10.要約と問題点
ヒト初代肝細胞はドナーの肝臓から精製できますが、1回の移植に必要な細胞数はおよそ1〜5 x109個であるため、大量のドナー肝臓を入手するか、初代肝細胞を培養して増殖させる必要があります。しかしながら、初代肝細胞を治療目的や基礎研究に利用しようとしても、組織培養環境での増殖後、急速に脱分化し、ほとんどの肝機能を失う傾向があるため、不可能でした。ドナー肝臓から精製した初代肝細胞を増殖させる方法は、肝細胞を産生する幹細胞を用いることで回避できます。ES細胞やiPS細胞は能力を失うことなく無期限に増殖することができます。iPS細胞を用いることの魅力は、自家肝細胞の供給源となり得ることです。ヒト胚性幹細胞から肝特性を示す細胞への分化については、いくつかの研究で報告されていますが、iPS細胞でも効率的に肝細胞様細胞を作製できることを示した報告は、今回が最初です。著者らは、マウスiPS細胞を誘導して無傷の胎児肝臓を効率的に生成できること、そしてhiPS細胞を培養中に誘導して高度に分化した肝細胞を作製できることを示しました。肝臓の生体内環境と比較すると、培養中の条件は人工的であり、iPS由来の肝細胞の機能に影響を与える可能性が高いことが予想されます。とは言うものの、上記のデータは、皮膚細胞からiPS細胞を介して肝細胞の特徴を持つ細胞を作製できることと、そのような細胞が哺乳類の肝実質に生着できることを示しています。
一方で問題点もあります。記載された手順を用いると、hiPS細胞からの肝細胞様細胞の作製は、huES細胞で観察されたものと同様に効率的であるように思われますが、微妙な違いが認められました。このような遺伝子発現の違いが、huES細胞に見られるように、単に異なるiPS株間の異質性を反映しているのか、それともすべてのhiPS細胞一般で特徴的なものなのかは、現時点では明らかではありません。また、作製されたhiPS細胞株の一つ(iPS C3a)は、多能性の特徴のほとんどを持っていたにもかかわらず、マトリゲル上にプレーティングすると、すぐに線維芽細胞様の形態に分化しました。同様に、一部のhiPS細胞株は不完全に初期化されているようであり、他の細胞株は外来性導入遺伝子の発現を維持し、分化プロトコールで誘導できない可能性があることが、他の研究者によって指摘されています。また、肝細胞の特徴をほとんど示す細胞の作製効率は高いものの、薬物代謝と異種物質応答の制御に重要な役割を持つ第一相および第二相酵素をコードするmRNAのレパートリーが、死体肝臓と比較して不完全であることに気づいています(図9c参照)。毒性学的研究や薬物代謝研究のための肝細胞源としてiPS細胞を使用するには、第一相および第二相酵素の発現を完全に同一化できる培養条件を確立する必要があります。以上のことを念頭に置くと、異なる患者や組織由来のhiPS細胞から分化細胞を作製する際の再現性を確保するために、hiPS細胞の作製と特性解析のための標準化をコミュニティ全体で進めることが極めて重要であると考えられます。
次はコラム第15話です
コラム第14話では多能性肝細胞を分化誘導して得た肝細胞様細胞を用いて肝臓ヒト化マウスを作製していますが、肝臓内に直接移植しており、しかも血中のヒトアルブミン値も示されていません。これまでのコラムを読んできていただいた方にとっては、ちょっと物足りないと思われていると思います。このモヤモヤを解消できるかどうか今は申し上げませんが、コラム第15話から第17話では、ヒトiPS細胞由来の肝細胞を利用した肝臓ヒト化マウス作製の論文を取り上げて説明したいと思います。一番わかりやすいポイントは血中アルブミン値ですが、果たしてどのくらいなのか、興味津々でお待ちいただけると幸いです。次回は、「Chen et al. Rapid Generation of Mature Hepatocyte-Like Cells from Human Induced Pluripotent Stem Cells by an Efficient Three-Step Protocol. Hepatology 55:1193-1203, 2012」の紹介です。