肝臓ヒト化マウスの歴史 第13話
株式会社トランスジェニック 顧問 山村研一
前回のコラムでは、レトロルシン(retrorsine)によるラット同種移植による肝臓置換効率の向上について1998年に発表された論文「Laconi et al. Long-term, near-total liver replacement by transplantation of isolated hepatocytes in rats treated with retrorsine. Am. J. Pathol. 153 319 329 1998」を紹介しました。回り道をしましたが、背景を理解していただけたと思います。今回は、その22年後に発表された論文で、肝臓ヒト化マウス作製でレトロルシンの有用性を示した論文「Michailidis et al. Expansion, in vivo-ex vivo cycling, and genetic manipulation of primary human hepatocytes. Proc Natl Acad Sci USA. 117:1678-1688, 2020」を紹介したいと思います。
1.研究目的と要約
肝細胞は肝臓の体積の80%、細胞数では60%を占めている主要な細胞型です。アルブミンをはじめとする種々のタンパクの産生や薬物代謝等において重要な役割を果たしています。さらに、ヒトの肝細胞は、B型肝炎ウイルス(HBV)、C型肝炎ウイルス、マラリアの原因となるマラリア原虫など、いくつかの肝志向性病原体の宿主です。ヒト肝臓から単離された初代ヒト肝細胞(primary human hepatocyte: PHH)は、肝細胞生物学研究のゴールドスタンダードとなっています。しかし、2020年当時のPHHには、ドナー間のばらつきと質の高いドナー(若年齢ほどいい)の入手の制限、分離・調達のための高い経済的コスト、対外へ取り出し培養しても機能がすぐに失われるなどの大きな制約がありました。一方、多能性幹細胞(pluripotent stem cell: PS cell)から肝細胞様細胞(hepatocyte-like cells: HLC)への分化を含め、ヒト肝細胞の再生可能な供給源が模索されてきました。例えば、人工多能性幹細胞(induced pluripotent stem cell: iPS cell)からHLCを作製できるなど、このアプローチには大きな可能性があります。しかし、現在のHLCは成熟した肝細胞ではなく、胎児の肝芽細胞に似ており機能的に不十分です。また、PHHからオルガノイド(スフェロイドspheroidとも言います)(図9にでてきます)を形成させ増殖させるためのプロトコールも開発されてきました。より広く行われているアプローチとしては、PHHの生着と増殖に有利な環境を提供するために、種々の肝細胞障害を持つ免疫不全マウスにPHHを移植し、肝臓ヒト化マウスを作製することです。このためにFah-/-:NOD:Rag1-/-:Il2rg-/-(FNRG)マウス(コラム第10話で紹介しました)など、広く用いられているマウスモデルがいくつかあります。このモデルでは、2-(2-ニトロ-4-(トリフルオロメチル)ベンゾイル)シクロヘキサン-1,3-ジオン(NTBC)の投与を中止することで、肝細胞障害が誘発されます。この方法では、障害されたマウス肝臓に由来するシグナルと、マウス肝細胞が死滅することによる空きスペースができることによって、移植した肝細胞が増殖できると推定されています。これらにより肝臓が高度にヒト化されれば、ヒト肝細胞を再単離することができると思われます。しかし、現在までのところ、ほとんどのPHHドナーは再増殖が不十分で、ヒト肝細胞による置換率は個体によってばらつきが大きいのが欠点です。
この論文では、移植したヒト肝細胞による置換率を改善させ、そこから使用可能なPHHドナープールを拡大できるプロトコールについて述べています。具体的には、一旦作製肝臓ヒト化マウスから単離した「マウス継代一次ヒト肝細胞(mouse-passaged primary human hepatocytes:mpPHH)」の長期培養法を確立し、薬物代謝研究や、ヒト志向性病原体感染研究に応用できることが示されました。特筆すべきは、プレート効率が不十分なPHHでも、肝臓ヒト化マウスを通して回収し継代することができ、このプロセスによって、試験したほとんどすべてのmpPHHのその後のプレート化候率がばらつくことなく均質化されました。さらに重要なことは、mpPHHをレンチウイルスベクターで形質転換し、増殖させてそのまま生体外での応用に使用したり、遺伝子改変ヒト肝細胞を持つ肝臓ヒト化マウスを作製できることです。これにより、これまで不可能であったヒト肝臓生物学の実験的研究の扉を広く開くことができるようになったと思われます。
2.方法論
(1)肝細胞
凍結保存したPHHは、Triangle Research LabsとLonzaから購入するか、外科検体から単離しています。
(2)マウス
Fah-/-マウスはオレゴン健康科学大学(オレゴン州ポートランド)のMarkus Grompe博士から提供され、NOD:Rag1-/-;Il2rg-/-マウス(Jackson Labs)と交配し、FNRGマウスを得ています。最初のNTBC除去サイクル後、著者らの施設ではFNRG雌の生存率は67.3±17.1%ですが、FNRG雄の生存率は1.8±3.6%と非常に低いことが分かりました。したがって、この論文での実験にはFNRG雌のみを用いています。FNRGマウスは、16μg/mL(原文では16mg/mLになっていますがそれは間違いです)のNTBC(Yecuris社)を含む飲料水で維持しています。
(3)マウスの事前準備:レトロルシン投与
レトロルシン(カタログ番号R0382;Sigma Aldrich)は、56℃で100%エタノールに20mg/mLで溶解し、-20℃で保存しています。腹腔内注射では、100μL(2mg)のレトロルシンまたは100μLのエタノールを、カルシウムまたはマグネシウムを含まない400μLのリン酸緩衝生理食塩水(PBS)で希釈しています(PBS-/-)。レトロルシンを2週間間隔で投与し、通常、最初の投与は移植の3~4週前に、2回目の投与は移植の2~3週前に行っています(図1a)。レトロルシンは、CYP450によって代謝され活性化されますが、このP450は発現のレベルが時間によって異なり、つまり1日の中でリズムがあります。マウスは午前7時(ZT0)から午後7時(ZT12)までの12時間の光サイクル下で飼育されています。そして、どの時間にレトロルシンを投与するのがいいのかを検討するため、ZT0での注射は午前7時から8時の間、あるいはZT12での注射は午後7時から8時の間に行っています。
(4)NTBCの離脱と肝細胞の移植
雌性FNRGレシピエントはNTBCから離脱して4~5日後に移植しています。
(5)肝臓の灌流と肝細胞の単離
一旦作製した肝臓ヒト化マウスの肝臓から、ヒト肝細胞を以下のように単離しています。簡単に説明しますと、マウスをケタミン/キシラジンで麻酔し、24ゲージの注射針を下大静脈に挿入し、次に門脈を切断した後、0. 05% IV型コラゲナーゼ(Sigma Aldrich)と1U/mL DNase(Thermo Fisher)を添加したHBSSで灌流し消化しています。細胞をバラバラにした後を含むで洗浄し、細胞ペレットをプレーティング培地に懸濁し、トリパンブルーを用いて生存細胞をカウントしています。生存率は通常95%以上でした。新しいFNRGレシピエントマウスへの移植のために、細胞をPBSに再懸濁し、各マウスにつき、0.5~1x106個を含む細胞懸濁液65μLを注射しています。ちょっと話が飛びますが第19話ではここでいうPHHから肝前駆細胞の誘導の論文(Zhang et al. Cell Stem Cell23:806-819, 2018)を紹介する予定ですが、こちらの方は種々の因子を用いています。それと対照的にこの論文でのmpPHHは増殖し形質転換できるにも関わらず、特別な増殖因子を用いているわけではなさそうです。乞うご期待といったところでしょうか。
(6)スフェロイド3D培養
コンフルエントになったmpPHH培養細胞を、red fluorescent protein (RFP)発現レンチウイルスで形質導入しています。10日後、細胞を剥離し、洗浄した後、培養皿にプレーティングしています。プレートを40×gで5分間遠心し、凝集体形成を促進しています。スフェロイド凝集体はプレーティング後1~3日の間に形成されます。培養10日後、プレーティング細胞数に応じて異なるサイズのスフェロイドが形成されます。
(7)その他の詳細な方法論
上記以外の方法については省略します。
3.肝臓ヒト化マウス作製におけるレトロルシンの効果
PHHをin vivoで、あるいはex vivoでの研究に供するため、肝臓ヒト化マウスからヒト肝細胞を単離しますが十分な数を確保するため、最低レベルのヒト化が必要です。ほとんどの場合、最低レベルでも約10%が必要ですが、これは、ヒト肝細胞のマーカーとして確立されている血清ヒトアルブミン(hAlb)値で言えば1 mg/mLに相当します。残念ながら、現在のプロトコールでは、多くのドナーのPHHの生着率は低く、その後の使用に必要な程度のヒト化が達成されたマウスはほとんどいません。この問題に対処するため、著者らはPHHドナーの大多数が常に10%以上のキメラを持つマウスを作製できるようなプロトコールを確立することを目指しました。
ラットでは、ピロリジジン系アルカロイドのレトロルシンが、部分肝切除や四塩化炭素投与後のドナー肝細胞による肝再増殖を促進します。そこで、PHH移植の前にFNRGマウスにレトロルシンを2回注射するというプロトコールで、マウスの血清中のhAlbレベルが上昇するかどうかを調べています(図1a)。3人のドナーからのPHHで、レトロルシンはマウスの生存率に影響することなく、hAlbレベルを改善しました(図1b)。レトロルシン処理により、再増殖が悪いドナーのPHH1とPHH2を移植したマウスで、hAlbレベルをそれぞれ23倍と30倍増加させています(図1b)。対照的に、もともと再増殖(生着率)がよいドナーであるPHH3を移植したマウスでは、レトロルシンはわずかな効果(2倍の増加)しかありませんでした。hAlbレベルと一致して、フマリルアセト酢酸ヒドロラーゼ(FAH)の組織学的染色では、レトロルシン処理したヒト化NOD:Fah-/-;Rag1-/-;Il2rg-/-(huFNRG)マウスの肝実質の大部分がヒト肝細胞に置換されていることを示しました(図1c)。さらに10種類のPHHドナーを試験したところ、そのうちの9つでレトロルシンの投与後にhAlbのピーク値が高くなることがわかりました。13のドナーの平均で、レトロルシンはコントロールマウスより9.5倍高い血清hAlbピーク値を示しました(P = 0.003)(図1d)。この結果から、レトロルシンの投与は、多くのPHH ドナーの生着率を改善することが確認されました。
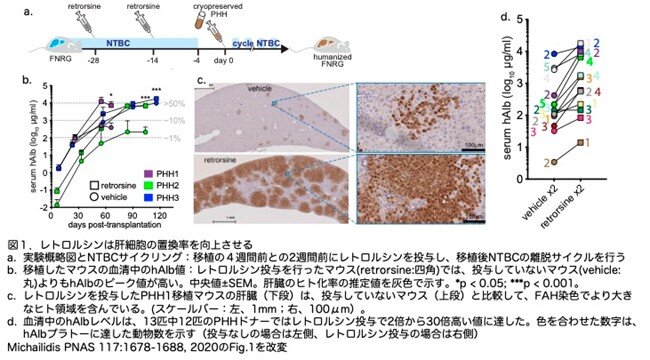
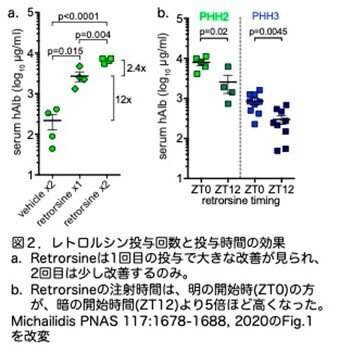
PHHの生着に対するレトロルシンの効果の程度は、1回の投与で大きく改善し、2回目の投与でわずかな効果しか得られませんでした(図2a)。PHH3では、3回目の投与による効果はありませんでした(血清hAlbの1.02倍増加、n=11の2回投与対n=9の3回投与、P=0.98)。
ラットモデルでは、レトロルシンはCYP450酵素によって活性化されますが、このP450は発現のレベルが時間によって異なり、1日の中でリズムがあります。そこで、レトロルシンを1日の異なる時間に注射を行い、効果に影響があるかどうかを検討しました。レトロルシンをZeitgeber time 0 (ZT0) (ドイツ語のZeitgeberはTime giver:明周期の開始時刻をZT0,暗周期の開始時刻をZT12とする12/12時間の明暗周期に おける体内時計の時刻)に投与すると、ZT12に投与した場合よりもhAlbが5倍高くなりました(図2b)。明るい時間にP450は高くなりレトロルシンはより活性化され、ヒト肝細胞がより多く生着したと思われます。
4.ヒト化肝臓マウスからのPHHの単離
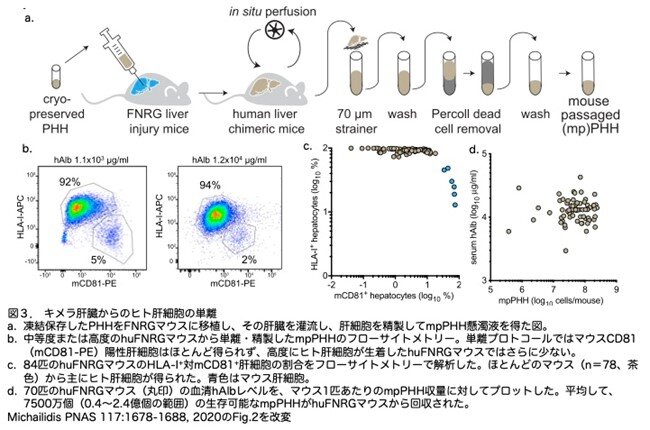
上記の結果から、レトロルシンにより肝臓が高度にヒト化されたマウスを入手できる可能性が高くなりました。そこで肝臓ヒト化マウスの肝臓(ここではキメラ肝と略称します)から生きたヒト肝細胞を濃縮するプロトコールを確立しています。レトロルシンを投与したhuFNRGマウスは、採取の少なくとも7日前にNTBCを中止し、huFNRGのキメラ肝を灌流し、パーコールおよび低速遠心分離によって肝細胞懸濁液を精製し、肝細胞(mpPHH)を濃縮しました(図3a)。中程度(1.1 mg/mL)および高濃度(12 mg/mL)のhAlbを示すhuFNRGマウスから分離したmpPHHのフローサイトメトリーから、著者らの分離/精製プロトコールでは、肝臓のヒト化の程度に関係なく、ヒト肝細胞が効率よく得られることが示されました(図3b)。まとめて84匹のhuFNRG肝臓を灌流し、精製後、フローサイトメトリーで細胞を分析し、ヒトおよびマウスマーカーの発現を測定しました。78匹のマウス(93%)で、このプロトコールによりヒト肝細胞を得ることができました(図3c)。高い収率を得るために、レトロルシンを投与しhAlb血清レベル約10 mg/mLの高度キメラhuFNRGマウスの肝臓を灌流しました。70匹のhuFNRGマウスから、1肝臓あたり40~240x106個で平均75x106 個のmpPHHが得られました(図3d)。これらのデータは、著者らの単離/精製プロトコールにより、高度キメラhuFNRGマウスからコンスタントに大量にヒト肝細胞を単離できることを示しています。
5.移植されたヒト肝細胞の肝実質への組込み
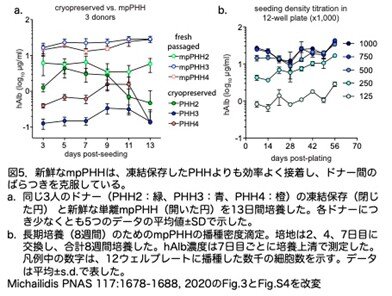
異なるドナーから凍結保存されたPHHは、マウスへの生着能や培養形成能にばらつきがあります。実際、6つの凍結保存PHHドナー(PHH2~PHH7)を、レトロルシン投与なしでFNRGマウスに移植し、血清hAlbによる生着を追跡すると非常にばらつき、PHH3(青色)を移植したマウスのhAlbの中央値が最も高いhAlbを示しました(図4a)。これらの結果に基づき、以降の実験では、特に指示がない限り、レトロルシン投与後にPHH3を移植したFNRGマウスを用いています。灌流により得たmpPHHを移植すると、凍結保存PHHを移植した場合よりも約150倍のmpPHHが得られました。キメラ肝臓における細胞分裂がmpPHHの品質に影響することを除外するため、移植後の肝臓で生着した肝細胞を再び移植したものと、移植せずに凍結保存したmpPHHをプレーティングした後の肝細胞(図4b)の安定性を比較しています。凍結保存mpPHH3または移植し得た新鮮なmpPHH3 をFNRGマウスに移植したところ、両群とも同程度のピーク値に達しましたが、新鮮なmpPHH3の方がhAlbの増加速度が速いことから、凍結保存mpPHH よりも再増殖能が優れていると思われます(図4c)。著者らは、mpPHHは1回の移植で高い再増殖能を保持し、凍結保存 PHHを20,000倍以上に拡大できると結論づけています。

移植したヒト肝細胞が一体何倍になるのかについて、その記載がある文の内容を簡単に補足しておきます。
このMichailidisらの論文では、
・「PHHを1x106を移植して(ここは推定)、平均75x106 個のmpPHHが得られました」との記載があります。
・そして、その後の文章で「灌流により得たmpPHHを移植すると、凍結保存PHHを移植した場合よりも約150倍のmpPHHが得られました」とあります。
・だとすれば、[75x106/1x106]x150=11,250となり約10,000倍になります。しかし、著者らは20,000以上に拡大できると記載しており矛盾があります。
この違いはどこからくるのでしょうか。その答えは「Overturf et al. Am. J. Pathol. 151:1273-1280, 1997 」にあります。それを抜粋すると以下のようになります。
・1万個の細胞を移植して、2−3ヶ月後に肝臓の中の細胞数は、3x107 個になる
・したがって、3000倍(3x107/10,000)になっている。
・しかし、脾臓に移植した場合、24時間以内に約15%(1万個移植すればその15%は1500個)しか肝臓に到達しないと推定しています(8,16)。ちなみに引用している「8」の論文では17%、「16」の論文では20%と記載されており、ちょっと低めに15%と書いたものと思われます。
・もしそうだとすれば、3000倍ではなく、20000倍(3x107/1500)になっていると推定できます。
原著の中で引用されているreference No.で書いておきます。
- Rhim JA, et al. Replacement of disease mouse liver by hepatic cell transplantation. Science 263:1149-1152, 1994
- Ponder et al. Mouse hepatocytes migrate to liver parenchyma and function indefinitely after intrasplenic transplantation. Proc Natl Acad Sci USA: 88:1217-1221, 1991.
いずれにせよこういう細かいことまで正確に推定し記述していることに頭が下がります。これが基礎研究の醍醐味のような気がします。
次に、mpPHH の肝細胞としての機能を保ったまま安定して培養できるかどうかを、上清中の hAlb を測定することにより評価しています。3人のドナー(PHH2、PHH3、PHH4)の凍結保存したPHHを培養すると、hAlbレベルはやや低いレベルで変動し、時間とともに低下していきました。一方、マウス移植後に継代した場合は、hAlbは高く安定して培養が可能で大量の肝細胞が得られました(図5a)。次に、mpPHH細胞の長期安定性を調べました。より高密度の mpPHH 培養ではコンフルエントな単層を形成し、hAlb の値から少なくとも 8 週間は安定でした(図5b)。
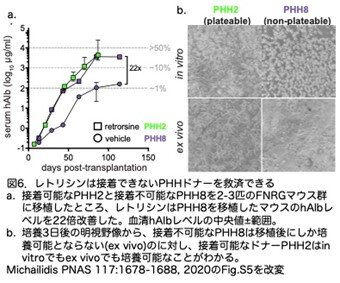
レトロルシンを投与したマウスでは、接着するドナー(PHH2)だけでなく、非接着ドナー(PHH8)でも1 mg/mL hAlbレベルを超えることがあったため(図6a)、マウスで継代する前(PHH)と後(mpPHH)で、接着性PHH2と非接着性PHH8とを培養し比較しまし た。接着性PHH2はin vitroとex vivo (mpPHH2)の両方で培養が可能でしたが、非接着性PHH8はex vivo (mpPHH8)でのみで接着しました(図6b)。
6.mpPHH細胞を用いての薬物代謝
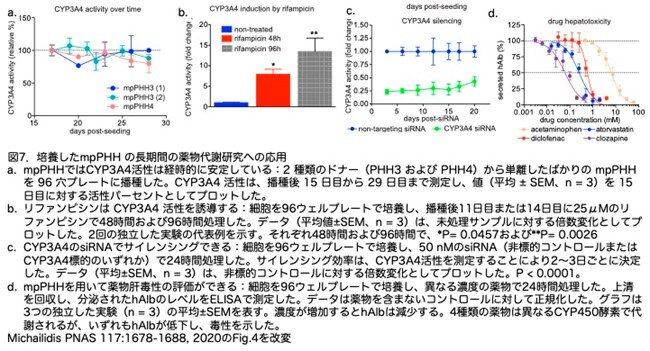
培養しているmpPHHの安定性を検証するため、前臨床薬物安全性試験への応用および薬物誘導能を検証しています。まず、2つの異なる mpPHH(mpPHH3 と mpPHH4)を用いて CYP3A4発現の安定性を解析しました。第 I 相 CYP450 活性は mpPHH 培養液で測定し少なくとも 1 ヶ月間保持されることが確認されました(図 7a)。次に、mpPHH が長期培養後も CYP450 活性を誘導する能力を維持しているかどうかを調べました。CYP3A4 の誘導剤として知られるリファンピシンを25μMの濃度で48 時間および 96 時間処理すると、時間依存的に CYP3A4 活性が 5~10 数倍誘導されました(図7b)。さらに、RNA 干渉(RNAi)を介したノックダウンによって CYP3A4 の酵素活性を修飾できるかどうかを低分子干渉 RNA(small interfering RNA: siRNA)法で検証しました。低分子干渉RNAとは21-23塩基対から成る低分子二本鎖RNAであり、mRNAの破壊によって配列特異的に遺伝子の発現を抑制できる方法です。mpPHH を CYP3A4を標的とする、または非標的コントロールで 24 時間処理し、処理後 20 日まで酵素活性をモニターしました。CYP3A4を標的としたsiRNAではmpPHH の長期培養中、CYP3A4 活性は検出されませんでした(図7C)。最後に、肝毒性学的研究へ応用できるかを評価するため、mpPHH を4種類の既知の肝毒性化合物の連続希釈液に曝露し、細胞傷害の指標として hAlb 分泌への影響を解析しました(図7D)。さらに異なる酵素(CYP3A4、CYP2E1、CYP2C9、CYP1A2)で代謝される薬剤で24 時間処理したところ、hAlbの分泌が用量依存的に低下したことから、肝毒性が観察され、その検証に使用できることが示されました。これらの実験を総合すると、mpPHH は長期の薬物代謝および薬物安全性試験に用いることができると思われます。
7.mpPHH細胞を用いての感染実験
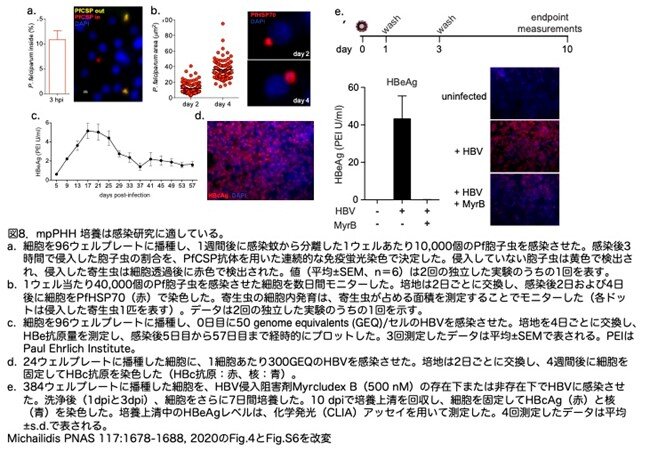
培養しているmpPHH細胞が、ヒト肝細胞にのみ感染する 2 種類の流行性肝志向性病原体であるマラリア原虫 (Plasmodium falciparum: Pf)と HBV の感染と増殖を支持できるかどうかを調べています。Pfに対するmpPHHの感染性を調べるため、寄生虫の侵入アッセイとPf特異的抗体による染色(細胞の透過性を上げる処理または処理しない状況)で行っています。これにより、細胞表面に結合しただけの寄生虫と、細胞内に侵入した寄生虫を区別することができます。平均して11%のPf寄生虫が肝細胞へ侵入しました(図8a)。次に、個々の寄生虫が占める細胞内面積を測定することで、寄生虫の成長を経時的にモニターしたところ、感染後2日目から4日目にかけて寄生虫のサイズが大きくなっていることがわかりました(図8b)。これらのデータから、mpPHHはPf寄生虫の効率的な感染と発育をサポートしていることが示されました。
HBV感染の慢性期の状態は、現在のPHHシステムでは寿命が短いため解析できません。我々は、mpPHHでは長期に培養できることを利用して、感染後8週間までHBV感染パラメーターをモニターしました。B型肝炎ウイルスe抗原(HBe抗原)は、96ウェル培養の上清中に8週間にわたって検出されました(図8c)。つまりmpPHHは少なくとも2ヶ月間はHBV感染を支持していました。さらに、感染後1ヶ月の時点で、B 型肝炎ウイルスコア抗原 (HBcAg) の強い発現が認められ、mpPHH内での持続的な感染を示しています(図8d)。
mpPHHは病原体感染や薬物毒性試験に適していたため、著者らはこのシステムをハイスループット・スクリーニングに適したマイクロスケールの384ウェルフォーマットに適応させています。この方法の有効性を実証するため、mpPHH細胞をHBVに感染させ、そのウェルの一部をHBV侵入阻害剤Myrcludex Bで処理しました。感染から10日後、未処理の細胞はHBVに効率よく感染しましたが、Myrcludex Bで処理した細胞は感染しませんでした (図8e)。
これらのデータを総合すると、mpPHHの培養の長期安定性は、短期では正確に研究できない様々なヒト肝細胞を用いた研究を可能にすることを示しています。
8.レンチウイルスベクターによるmpPHHへの遺伝子操作
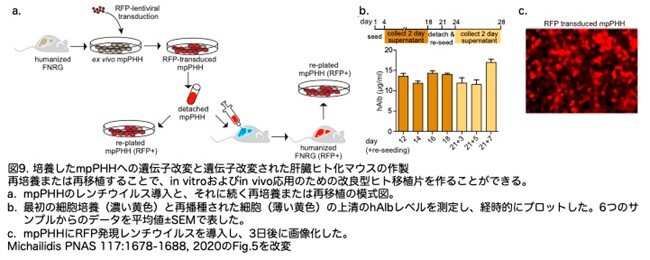
PHHの欠点の一つは、二次元(2D)培養ディッシュからの回収と播種ができないため遺伝子操作ができないことです。著者らはmpPHH培養の安定性から、赤色蛍光タンパク質(RFP)をマーカーとして、レンチウイルスベクターで肝細胞に形質導入するプロトコールの確立を目指しました。さらに、トランスフェクトし遺伝子改変したmpPHHを再培養または再移植して、遺伝的に操作されたヒト肝細胞を持つhuFNRGマウスを作製することを目指しました(図9a)。
この目的のために、レンチウイルスに感染させたmpPHHを3週間モニターし、その後細胞を回収して再培養しています。その結果、60~80%のmpPHHが生存し、また、回収前と同程度のhAlbレベルを持つmpPHHが樹立できました(図9b)。さらに、mpPHHの90%以上がRFP-レンチウイルスベクターで形質導入できる条件を決めることができました(図9c)。
9.スフェロイド肝細胞培養
上記の2つの技術的進歩を組み合わせて、2つの応用を試みています。最初に、96ウェルプレートにmpPHHをプレーティングして、三次元(3D)スフェロイド肝細胞培養を試みました。しかし、すでに形成済みのスフェロイドへのレンチウイルスRFP導入は、一貫して効率が悪いことが分かりました(図10a)。この問題を解決するために、まず2DでmpPHHに遺伝子導入し、細胞を回収し、スフェロイド形成を行いました。このプロトコールに従うと、スフェロイド細胞の90%以上がRFP陽性となりました(図10b)。この論文でのスフェロイド形成の結果はあまり印象的ではありません。しかし、マウスの肝臓の70%を切除しても一週間程度で元の重量と機能を回復するはよく知られている事実です。このときどの細胞が肝臓を再生するのかについて多くの研究が行われていますが、決着はついていません。最近この研究に肝臓スフェロイドが注目され使われています。興味ある方は一例として「Hu et al. Long-Term Expansion of Functional Mouse and Human Hepatocytes as 3D Organoids. Cell15: 1591-1606, 2018」をお読みください。このスフェロイドを利用する上で、ヒト肝細胞が必要ですが、その材料を十分量提供できるという意味で注目される論文と思います。
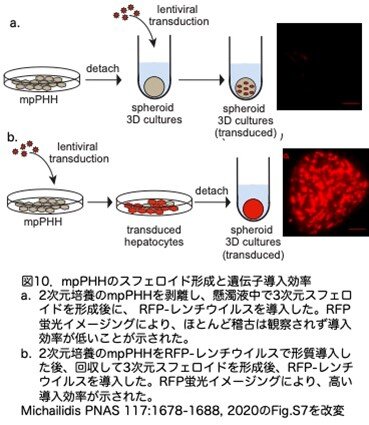
10.mpPHHを用いた遺伝子改変と肝臓ヒト化マウス作製
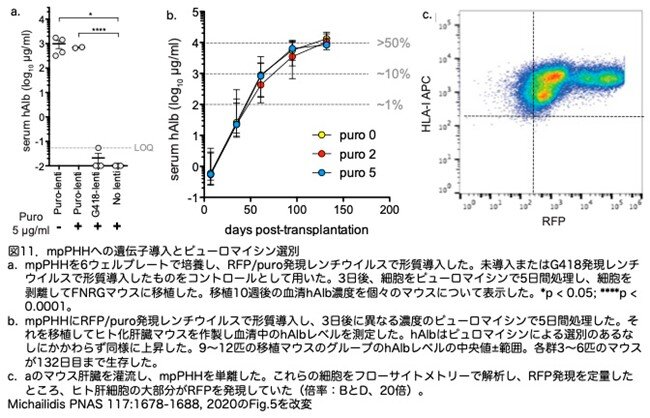
第2の応用としては、遺伝子導入したmpPHHを用いた肝臓ヒト化マウス作製です。この目的のため、mpPHHにRFPピューロマイシン耐性(RFP-puro)またはRFP-G418耐性(RFP-G418)レンチウイルスベクターを導入し、ピューロマイシンで選別できるかどうかを解析しました。ピューロマイシン存在下で5日間培養した後、mpPHHを単細胞培養に移してFNRGマウスに移植しました。移植後5週目に、RFP-puro-レンチウイルス導入mpPHHを移植したマウスで、ピューロマイシンの選択に関係なくhAlbが検出され(図11a)、これは、mpPHHが選択過程に耐えたことを示唆しています。予想されたように、RFP-G418-レンチウイルス導入および未導入のmpPHH培養はともに、移植5週後の血清hAlbレベルが最小でしたが、これは当然でピューロマイシン処理に耐えられなかったためです(図11a)。FNRGマウスにおける改変mpPHHの再増殖を確認するため、ピューロマイシン濃度0、2、5μg/mlで5日間処理したのち回収したmpPHHをFNRGマウスに移植しました。移植後5週目にmpPHHを移植したマウスで、ピューロマイシンで選択しても、選択しなかったときと同様にhAlbが検出されました(図11b)。このことは、ピューロマイシン選択過程に耐えたmpPHHが肝臓内で再増殖することを示唆しています。この知見は重要で、ピューロマイシンで遺伝子導入されたmpPHHを選別でき、そのmpPHHが生着増殖した肝臓ヒト化マウスを作製できることを意味します。移植から4ヵ月後、免疫組織化学的検査でキメラ肝臓で約50%の置換率が確認され、高い血清hAlb値と一致しました。これらのマウスの肝臓を環流し採取した肝細胞を用いてフローサイトメトリーを行ったところ、ヒト肝細胞の大部分がRFPを発現していました(図11c)。これらのデータは、mpPHHを2次元培養中に効率的に形質導入し、高度に形質導入された3次元スフェロイドを形成させたり、遺伝子改変mpPHHを高度に持つヒト化肝臓マウスの作製に使用できることを示しています。
11.要約
この論文は11ページに渡り、膨大な実験結果が示されていますので、肝臓ヒト化マウスを理解する上で割愛してもいいと思われる一部の結果は割愛しました。それらは、(1)TK-NOGマウスのデータ、(2)Alb-pUAのデータ、(3)fetal hepatoblastのデータ、(4)レトロルシンによるマウス肝細胞でのKi67および成長促進因子の発現データ、(5)mpPHHにおけるcytokeratin 18 (CK18) と nuclear mitotic apparatus protein (NuMA)の免疫染色のデータ、(6)凍結保存PHH(PHH3)と3匹の新鮮分離mpPHH3における第I相解毒遺伝子(すなわちCYP450)、第II相解毒遺伝子、および様々な肝臓特異的遺伝子(核内受容体、肝臓濃縮転写因子)のRNAseq (RNA sequence)解析データ、(7)mpPHH培養上清中の肝細胞マーカーであるヒトアルブミン、ヒトトランスフェリン、ヒト α-アンチトリプシン、尿素の測定データ、です。興味のある方は原著論文をご覧ください。
最後に要約を記載しておきます。レトロルシンで処理することにより、移植1回につきPHH数を効率的に約150倍に拡大し、凍結保存したPHHのドナー間ばらつきをなくし、置換効率を上昇させることができることが示されました。一旦作製した肝臓ヒト化マウスより単離したmpPHHは、数ヶ月間培養でき、これらの培養ヒト肝細胞を用い、HBV感染症、原虫感染症、薬物代謝研究、ハイスループットの遺伝子および化合物スクリーニング等を行うことができることが示されました。また、mpPHHを効率的に遺伝子操作できるため、遺伝子を改変したヒト化肝臓マウスを作製でき疾患研究に応用できることが示されました。
次はコラム第14話です
コラム第14話では、多能性幹細胞であるヒトESあるいはiPS細胞から分化誘導したhepatocyte-like cellを用いての肝臓ヒト化マウス作製の話で、「Si-Tayeb et al. Highly Efficient Generation of Human Hepatocyte-Like Cells from Induced Pluripotent Stem Cells. Hepatology 51 297 2010」の紹介です。PHHあるいはmpPHHと比較してどのくらいの置換率あるいは血中のhAlb濃度なのか、果たして多能性幹細胞由来の肝細胞は使い物になるのか気になるところだと思いますが、次回を期待しながらお待ちください。