肝臓ヒト化マウスの歴史 第13話 番外編2
株式会社トランスジェニック 顧問 山村研一
前回のコラムでは、ピロリジジンアルカロイド(pyrrolizidine alkaloid: PA)を概説するとともに1995年に発表された論文「Laconi et al. Carcinogenesis 16:139-142, 1995)」で、化学的に誘導された慢性肝疾患が、単離された正常な肝細胞の移植によって抑制あるいは回復されうることを紹介しました。それに続く同じグループによる本論文(Laconi et al. Long-term, near-total liver replacement by transplantation of isolated hepatocytes in rats treated with retrorsine. Am. J. Pathol. 153 319 329 1998)では、PAの一つであるレトロルシン(retrorsine)によるラット同種移植による肝臓置換効率の向上について紹介したいと思います。
本論文の着目点は以下の通りです。第1は、研究目的です。第2は、方法論です。マウスと比較してどこが同じで何が違うのかが興味あるところです。第3は、レトロルシン投与の影響の解析です。第4は、移植肝細胞の運命の追跡です。第5は、移植された肝細胞の肝実質への組込みです。第6は、雄ではDPPIV+肝細胞によるほとんど完全な置換です。第7は、移植された肝細胞の生化学的機能解析です。そして第8は、結果の要約です。なお、この論文での図の説明の仕方は、他の論文とは少し違う特徴を持っています。普通は、図の説明は本文で詳しく図説明文(いわゆるFigure legend)では簡潔に書くのですが、それとは逆にFigure legendの説明が詳しく書かれていました。Figure legendの文章を本文中に移そうかなとは思いましたが、本文の説明だけでも簡潔でかえって分かりやすかったので、そのままにしておきました。
1.研究目的
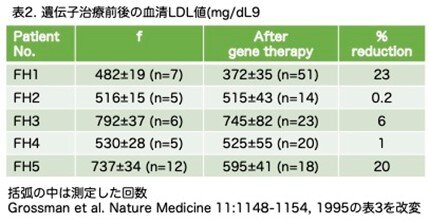
肝細胞移植による慢性疾患に罹患した肝の再増殖は、現在末期肝疾患の治療に用いられている肝臓臓器移植に代わる重要な方法です。しかし、この論文が発表された1998年の時点では、従来の肝細胞移植研究のほとんどにおいて、レシピエント臓器における移植細胞の増殖が十分ではないという大きな問題がありました。これらの具体例として引用されている8つの論文の要約を表1に示しました。この表の番号は、本論文で引用されている論文の番号をそのまま記載しています。置換率を推定するために、Reference 3 (Ref.3)とRef.4では血中コレステロール値、Ref.5ではビリルビン値、Ref.7ではBrdUの取込率を用いており、血清アルブミンのような正確に判断できる指標を用いていません。Ref.3では、low density lipoprotein receptor (LDLR)欠損ラット(血清コレステロールが高値になります)からラット肝細胞を取り出し、in vitroでLDLR遺伝子をレトロウイルスによる方法で導入したラット肝細胞を移植し、血清コレステロールが30~50%減少したことを確認しています。これと同じように、Ref. 4ではLDLR欠損患者のヒト肝細胞を 取り出し、in vitroでLDLR遺伝子をレトロウイルスによる方法で導入したヒト肝細胞を移植し、LDL/HDL(high density lipoprotein)の比が改善することを示しました。つまりヒトにおける最初の遺伝子治療例(いわゆるex vivo gene therapyと呼ばれる方法)で、私も初めてこの報告を読んで驚きました。翌1995年に別の論文で5人の患者についての結果が報告されていますのでご興味ある方はお読み下さい(Grossman et al. A pilot study of ex vivo gene therapy for homozygous familial hypercholesterolaemia. Nature Med. 11:1148-1154,1995)。どのくらい血清のLDLが低下するのかが大いに興味あるところですので表2に示しました。低下率の大きい順に23%、20%、6%、2%、0.1%で思ったほど低下していませんが、最初の例なので、この方法に問題なく患者が耐えられかどうかも関心事の一つだったようですが、耐えられるようですので望みがあるということです。
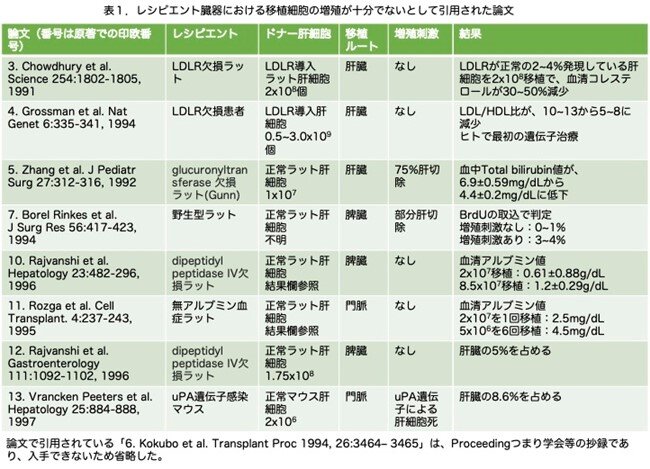
置換率を上げるために、一般的には肝部分切除術を用いて肝臓の一部を除去することで、移植細胞に増殖刺激因子を与えることができます(reference 5と7)。しかし、肝部分切除単独で細胞増殖を増強する方法には、大きな欠点があります。すなわち、肝臓を元の大きさに戻すには、1、2回の細胞分裂しか必要とせず効果を見るには早過ぎますし、また内在性肝細胞と移植肝細胞の両方が再生増殖過程に参加でき、移植した肝細胞に有利な状況ではありません。他のアプローチとしては、脾臓に大量の細胞(最大1x108細胞)を注入する方法(Ref. 10)、細胞を複数回移植する方法(Ref. 11,12)、あるいは細胞移植前にuPAを発現させて肝毒性を誘導する方法(Ref. 13)などがありますが、これらのアプローチでも肝臓の再増殖はわずかなものにとどまっています。
最近、肝細胞移植の2つの実験モデルが報告されました。ウロキナーゼ型プラスミノーゲン活性化因子トランスジェニックマウス(コラム第6話から第8話で紹介しています)とフマリルアセト酢酸ヒドロラーゼ(Fah)欠損マウス(コラム第10話で紹介しています)です。どちらも有用ですが、これらのモデルはいずれも遺伝子改変されておりユニークな遺伝的背景に依存しているため、肝細胞移植の一般的モデルとしての応用はかなり限定的なものであると述べられています。
そこで著者らは、内在性肝細胞よりも移植した肝細胞が選択的に増殖できるような別の方法を開発できれば、肝細胞再増殖のより一般的な有用なアプローチになると考えました。つまりコラム第13話番外編1で紹介したPAの一つであるretrorsine(レトロルシン)を用いて内在性肝細胞の増殖能を阻害し、その後肝部分切除後に正常肝細胞を移植することにより、移植肝細胞を選択的に増殖させる新しい方法について述べています。この方法の有効性は、特定のマーカー遺伝子であるジペプチジルペプチダーゼIV(dipeptidyl peptidase IV: DPP4)を発現していない近交系Fischer(F)344ラットに、正常にDPP4を発現している肝細胞を移植し、肝臓内で置換していくことができるかどうかを検証しています。
2.方法論
移植肝細胞の運命を追跡するために、レシピエントとしてDPPIV欠損(Dpp4-/-)F344ラットモデルを用いています。論文では「DPPIV-」となっていますが正しい命名は「Dpp4-/-」です)。このDpp4-/- F344ラット(以下「Dpp4-/-ラット」と略します)はAlbert Einstein College of MedicineのLiver Research CenterのSpecial Animal Coreから供与されています。肝細胞ドナーとなるDpp4+/+ ラットはCharles River Laboratories(Wilmington, MA)から購入しています。
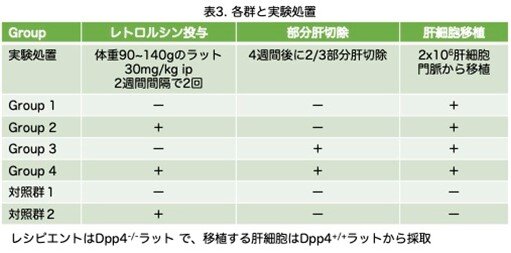
ラットは実験処置の有無により4つの実験群に分けられ:1)肝細胞移植を受けたが他の処置を受けなかった群、2)肝細胞移植とレトロルシンを受けたが部分肝切除は受けなかった群、3)肝細胞移植と部分肝切除を受けたがレトロルシンは受けなかった群、4)肝細胞移植、レトロルシン投与、部分肝切除を受けた群です。実験処理の順番は以下の通りです。1)体重90~140gのDpp4-/-ラットにレトロルシン(Sigma Chemical Co.) 30mg/kgを2週間間隔で腹腔内投与しています。この方法で、内在性肝細胞の細胞分裂を強力かつ持続的に阻害しますが、この効果は少なくとも数ヶ月は持続します(E. LaconiとP. Pani、未発表)。2)最後の注射から4週間後、2/3部分肝切除を行っています。3)最後に、ラットの門脈から2x106個の新鮮単離肝細胞を注入しています。肝細胞は、標準的な2段階コラゲナーゼ灌流法に従って、Dpp4+/+ F344の若齢成体ドナーラットより単離しています。細胞の生存率は、トリパンブルー色素排除法により判定し、常に85~95%でした。対照は、未処置のラットと、レトリシンを投与しましたが肝部分切除も細胞移植もしなかった群です。分かりやすいように表3にまとめました。各実験群のラットは、術後1日目から1年までの様々な時点で肝臓を凍結もしくはホルマリン固定し、肉眼的、組織学的、組織化学的、免疫組織化学的方法で解析しています。
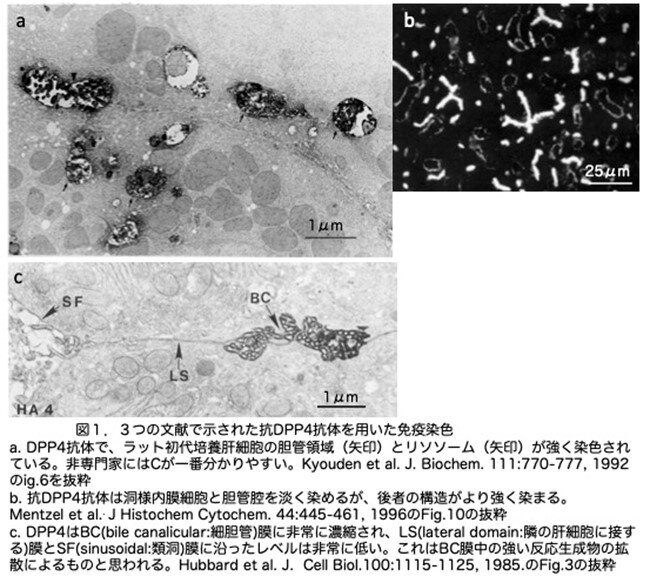
補足としてDPP4について少し説明をしておきたいと思います。肝臓の主要な上皮細胞である肝細胞には、機能的にも形態的にも異なる3つの表面ドメインがあります。1)類洞(sinusoidal : SF)ドメインは、血液との代謝産物の交換に特化しており、ディッセ腔に伸びる不規則な微絨毛と、多数の被覆孔が特徴的です。2)側方(lateral: LS)ドメインは、隣接する肝細胞のLSドメインと接触しており、部分的には細胞接着と細胞間コミュニケーションに特化しているため、タイトジャンクション、デスモソーム、ギャップジャンクションなどの細胞接着要素が特徴的です。3)LSドメインとは別の胆管(bile canalicular: BC)ドメインは、胆汁分泌に特化しており、多数の微絨毛によって特徴づけられています。DPP4は膜エキソペプチダーゼですが、肝細胞では、その発現が細胞膜の頂端膜ドメインに局在するという点で特異的です。頂端膜(ちょうたんまく、apical membrane)とは、内腔に面した細胞膜の表面のことで、分かりやすく言えば血液(類洞ドメイン)や胆汁(胆管ドメイン)が流れる管腔に面しています。図1ではDPP4に対する抗体を用いて免疫染色を行うとどのように見えるのか3つの論文の例(a, b, c)を示しておきます。論文によってずいぶん違うという感想を持たれるのではないかと思います。
肝臓の構造を知っていないと理解し難いので図2に肝臓の組織構造を示しました。ここでは説明しませんが図を見ていただければ非常に複雑であることが分かると思います。
3.レトロルシン投与の影響
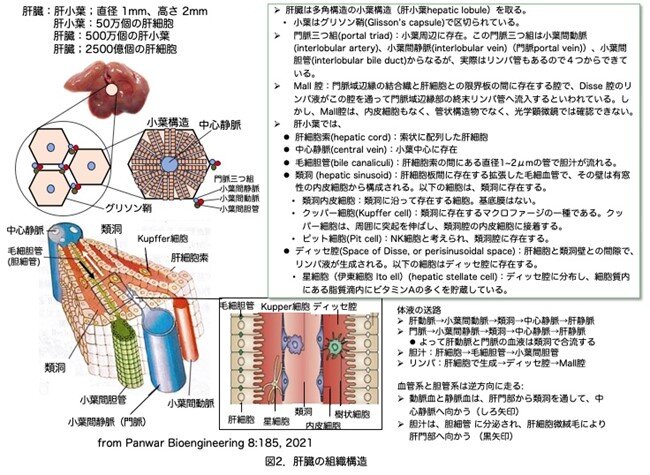
Dpp4―/― F344ラットのレトロルシン処理、肝細胞の単離と移植、および3分の2肝部分切除を行っても、95%のラットは生存しています。レトロルシンの急性作用である肝類洞の拡張とうっ血、軽度の炎症、胆道上皮細胞の増殖などが治まった後、肝実質では肝細胞索構造の軽度から中等度の崩壊、残存する胆菅細胞の過形成、散在する肝細胞巨細胞化がみられました(図3a)。肝部分切除(細胞移植の有無にかかわらず)後、肝巨細胞が顕著に増加しています(図3b)。これらは部分肝切除後にレトロルシン処理した肝細胞でDNA合成が起こりますが、有糸分裂を起こすことができませんので巨大核を持つ細胞になります(文献22-25およびE. LaconiとP. Pani、未発表の観察結果)。小さな肝細胞が集まっている局所も観察されました(図3b)。線維化は認められず(図3c,d)、慢性肝疾患、肝新生物の形跡もありませんでした。細胞移植の時点で、肺、心臓、脳、胃、小腸、結腸、腎臓、膵臓、副腎、精巣、卵巣を含む他の臓器にレトロルシン毒性の証拠はありませんでした。
4.移植肝細胞の追跡
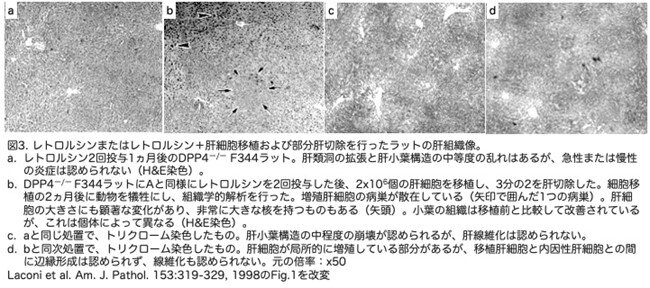
移植した肝細胞の増殖、拡大、および肝実質構造への統合を、形態学的および組織化学的分析によって解析しています。レトリシンと部分肝切除を行った雌ラットに2x106個の肝細胞を移植した1日後にDPP4陽性(DPP4+)細胞を見つけるのは困難でしたが、DPP4+細胞は門脈三つ組(図2参照)またはその近傍の肝類洞に単細胞で出現することがほとんどでした(図4a)。最初、組織化学染色ではDPP4の発現は胆管には限局せず、細胞表面に拡散していました。移植後4日目には、2~4個のDPP4+肝細胞群が典型的な胆管染色を示すようになり(図4b)、2週間後には、DPP4+肝細胞が2次元断面積で25~50個の細胞からなるクラスターとして出現しました(図4c)。移植後1ヶ月では、DPP4+肝細胞のクラスターは100から数百個の細胞からなり(図4d)、移植後2ヶ月では1000個以上の細胞からなり、肝臓は多くのクラスターで占められるようになりました(図4e)。術後2週間の雌ラットにおいては、コンピュータを用いた形態分析によると、肝細胞量の約3〜5%がDPP4を発現しており、1ヵ月後には15〜25%、2ヵ月後には40〜60%に増加しました。実験期間である1年間の肝細胞置換は、このレベルでほぼ一定でした。肝部分切除を行いましたがレトロルシンを投与しなかったラットでは、移植肝細胞の有意な増殖は見られませんでした(データは示さず)。肝細胞の移植を受けたが肝部分切除を受けなかったレトロルシン処置雌性ラットにおいても、移植後4ヵ月まで移植細胞の増殖はほとんど見られませんでした(図4e)。
5.移植された肝細胞の肝実質への組込み
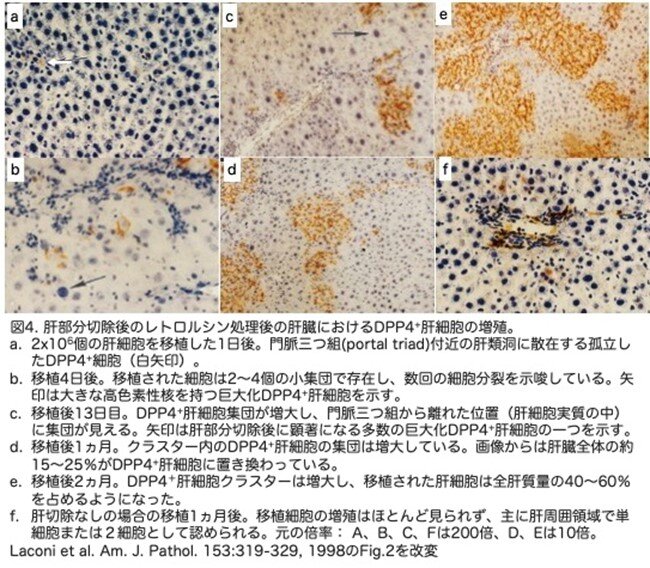
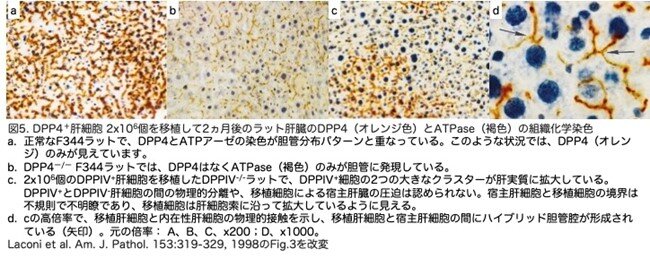
移植され増殖した肝細胞が肝実質に構造的に統合されるかどうかを調べるため、ATPase(褐色)とDPP4(オレンジ色)を用いた二重組織染色が行われています。この2つのマーカーは肝細胞の同じ部位に発現しています。正常なF344ラットでは、両方の染色が陽性で2重染色されているはずですが、この状況では、ATPaseの褐色はDPPIV(オレンジ色)に隠れています(図5a)。対照のDpp4―/― F344ラットでは、ATPaseは陽性(褐色)でしたが、DPP4は陰性でした(図5b)。Dpp4―/―ラットにDPP4+肝細胞を移植して2ヵ月後、DPP4+肝細胞の大きなクラスターが認められました(図5c)。移植されたDPPIV+肝細胞と内在性DPPIV―肝細胞との間に境界はなく、移植細胞は周囲の肝臓領域に拡大しているように見えました。移植細胞は肝実質と完全に一体化し、隣接 するDPP4/ATPaseの内在性肝細胞とハイブリッド管腔を形成していました(図5d、矢印)。
6.移植された肝細胞の肝実質への組込み
雌性ラットと同じプロトコールで処置した雄性F344ラットでは、移植したDPP4+肝細胞による肝臓置換の速度と程度は劇的に増大しました。2x106個のDPP4+肝細胞を移植して1日後、単一のDPP4+細胞が主に門脈周囲で観察されました(通常、x4またはx10の対物レンズを使用しても、1門脈領域あたり1フィールドに1個または数個の細胞しか観察されませんでした;図6a)。移植後2週間で、DPP4+肝細胞はすでに100個以上のクラスターが切片で観察され(図6b)、雌ラットで1ヵ月後に観察されたレベルに匹敵しました。移植後1ヶ月で、DPP4+肝細胞は肝細胞総量の約50%を占めました(図6c)。2ヵ月後には、移植されたDPP4+肝細胞は肝実質量の90〜95%を占め(図6d)、4ヵ月後には、肝細胞の置換はほぼ完全になりました(98%;図6e)。この高レベルの再増殖は、コンピュータ支援画像解析によって9ヵ月目で99%と判定され、実験期間中は持続しました(図6f)。残存する内在性肝細胞は、通常非常に大きな核を有し、DPP4酵素活性はもちろん陰性で、小葉の縁およびいくつかの中心静脈のすぐ隣の領域で観察されました(図6e、矢印)。部分肝切除を行わなかった雄ラットでは、DPP4+肝細胞の増殖もかなり限定的でしたが、数匹では1ヶ月以内に3〜5%に達しました。より少ない移植細胞で効果的な肝臓置換が得られるかどうかも調べています。10,000個のDPP4+肝細胞を移植したラットでは、9ヵ月後には置換率は30~50%になりました(図6g)。100個のDPP4+肝細胞を移植したラットでも、1ヵ月後に1匹を除くすべてのラットでDPP4+肝細胞のクラスターが認められました。6ヶ月の時点で、肝臓の断面に2〜6個のDPP4+肝細胞のクラスターが観察されました。これらのラットでは、移植された細胞のクラスターは二次元断面上で様々な大きさであり、より大きなクラスターは数百の肝細胞を含んでいました(図6h)。
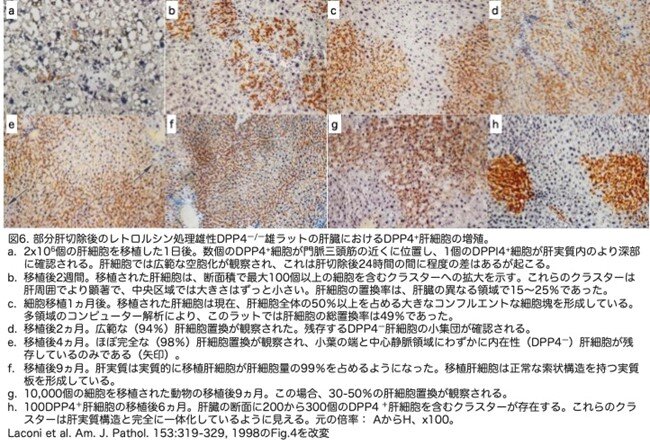
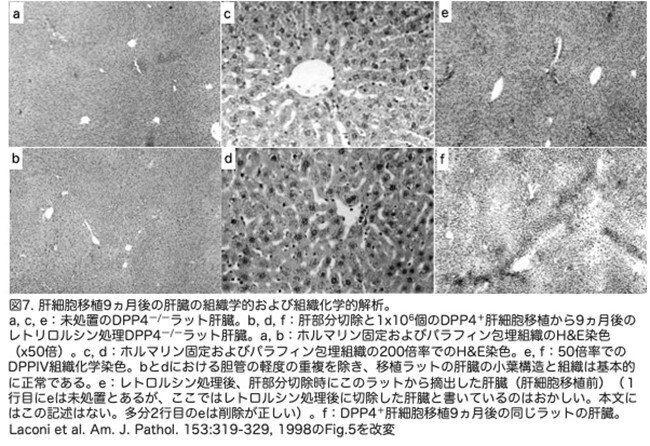
雄のDpp4―/―F344ラットにDPP4+肝細胞を移植して9ヵ月後の肝臓の最終的な外観を、正常ラットの肝臓と比較して図7に示しました。低倍率のヘマトキシリン・エオジン(H&E)染色(図7a, b)で示されるように、小葉構造および全体的な組織学的外観は基本的に正常でした。高倍率(図7c,d)では、肝細胞の形態、肝細胞索構造、洞内膜細胞の外観は、未処置の肝臓と比較しても正常でした。一貫して観察された異常は胆管のわずかな重複で、これはレトロルシンを投与したすべての動物に生じていました。細胞移植前(図7e)後(図7f)のDPPIV組織化学染色で示されるように、肝細胞の置換の程度はほぼ完全であり(との記載ですが、白黒写真で判別できません)、わずかにDPPIV―細胞が小さなクラスターに残っているだけでした。図7fはまた、移植肝細胞による正常な肝細胞索構造の回復を示しています。
7.移植された肝細胞の肝実質への組込み
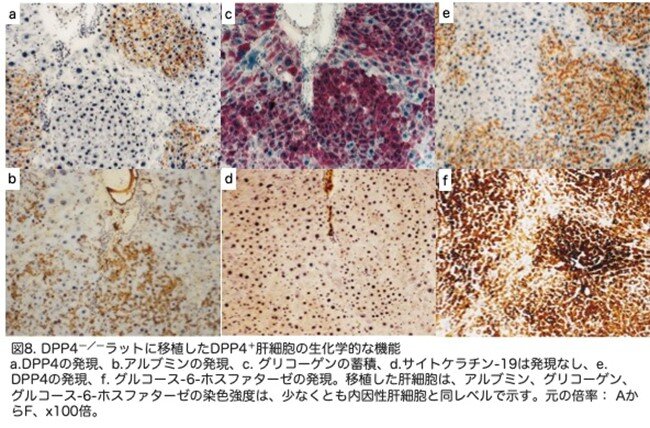
移植された肝細胞が肝細胞特有の生化学的機能を保有しているかを調べるため、アルブミン合成、グルコース代謝、糖新生について、連続切片を用いて調べられました。細胞移植の1ヵ月後、DPPIVを発現する肝細胞の大きなクラスター(図8a)は、アルブミンの合成(図8b)とグリコーゲンの貯蔵(図8c)も示しました。同様に、DPP4+肝細胞のクラスターでは(図8e)、グルコース-6-ホスファターゼも高発現していました(図8f)。移植肝細胞はサイトケラチン-19(図8d)やγ-グルタミルトランスペプチダーゼ(データはなし)を発現しなかったことから、これらの細胞は胆管上皮細胞系ではなく肝細胞系であることが示されました。移植肝細胞はα-フェトプロテインも陰性でした(データはなし)。
8.移植された肝細胞の肝実質への組込み
ピロリリジンアルカロイドであるレトロルシンは、肝細胞の細胞周期をブロックし、S期後期および/またはG2期にある細胞を蓄積させます。ピロリジジンアルカロイドは速やかに代謝されますが、肝細胞増殖に対する効果は数週間から数ヵ月間持続します。このレトロルシン投与と部分肝切除を行うと、移植した肝細胞が著しく増殖し、雌ラットでは肝臓の40〜60%が1年間置換されることが観察されました。雄ラットでは、肝細胞量のほぼ完全な置換が観察され(98〜99%)、移植後9ヵ月間(実験期間中)持続しました。また、移植肝細胞と内因性肝細胞の間にもハイブリッド管腔が観察され、移植した DPP4+肝細胞と宿主DPP4―肝細胞の間に分離は見られませんでした。2~4ヵ月後、移植DPP4+肝細胞は類洞内に内皮細胞、クッパー細胞、伊藤細胞を持つ正常な肝細胞索を形成し始めました。9ヵ月後までには、肝実質の構造は、胆管の再増殖がわずかであることを除けば、正常に回復しました。今回、図2に肝臓の組織構造を示しましたが、肝細胞しか移植していないのにこのように複雑な肝臓の組織構築に参加できるのは不思議でもあります。また、なぜ雄では置換率がいいのか興味あるところですが理由は不明です。
次は本来のコラム第13話です
番外編が続きましたがいかがだったでしょうか。コラム第4話では、Tg(MT-nLacZ)マウス成体肝細胞をTg(Alb-Plau)に移植、つまり同種移植で、置換率は80%であることを紹介しました(Rhim et al. Science 263:1149-1152, 1994)。本論文はラット肝細胞のラットへの移植ですから、やはり同種移植になります。同等の成績を示しているにも関わらず、レトロルシンを用いた実験は、次回紹介する論文「Michailidis et al. Proc Natl Acad Sci USA. 117:1678-1688, 2020」まであまり顧みられることはありませんでした。理由は不明ですが、ピロリジンアルカロイドという物質を用いるので、よほどアドバンテージがないと用いる気にならなかったのではと推察しています。ではどのようなアドバンテージがあるのか次回を期待しながらお待ちください。