肝臓ヒト化マウスの歴史 第15話
株式会社トランスジェニック 顧問 山村研一
コラム第15話から第17話では、ヒトiPS細胞由来またはES細胞由来の肝細胞を利用した肝臓ヒト化マウス作製の論文を取り上げて説明したいと思います。肝臓ヒト化マウスの有用性を評価する上で一番わかりやすいポイントは、移植したヒト肝細胞がマウス肝臓内で何%(どれくらい)を占拠できているかという点です。しかし、これは調べるのが大変ですので、血中アルブミン値で代行することができます。すでにコラムでも紹介していますが、初代ヒト肝細胞を移植した場合は、10%を占拠すると血中アルブミンが1mg/mLになりますので、100%だと10mg/mLとなります。血中アルブミンがだいたい7~8mg/mLになれば、肝臓ヒト化マウスとしての利用価値があると評価されるようです。これを目安として覚えておいていただき、幹細胞由来の肝細胞移植によりその血中アルブミン値が果たしてどのくらいなのか注目していただいて、順次紹介していきたいと思います。まずは、「Chen et al. Rapid Generation of Mature Hepatocyte-Like Cells from Human Induced Pluripotent Stem Cells by an Efficient Three-Step Protocol. Hepatology 55:1193-1203, 2012」の紹介です。
1.研究目的と要約
ウイルス性肝炎や薬剤は、しばしば肝障害や肝硬変を引き起こします。肝移植は末期肝疾患に対する有効な治療法ですが、慢性的な免疫抑制による重篤な副作用や適切なドナー肝臓の不足が肝移植の大きな障害となっています。コラム第14話で紹介しましたように、4つの転写因子を発現するウイルス導入によって、マウスやヒトの体細胞を人工多能性幹細胞(iPS細胞)にリプログラミングすることが可能となっています。ヒト胚を用いて作製するヒト胚性幹細胞(ES細胞)とは異なり、ヒトiPS細胞は、ヒト胚を用いることに伴う論争、つまりヒト胚も一つの生命とみなしうることから生じる論争を回避できます。iPS細胞の遺伝子発現パターンはヒトES細胞と同一ではありませんが、ヒトiPS細胞は多能性を有しているため、生体のすべてではありませんが、ほとんどの細胞型に分化することができます。したがって、ヒトiPS細胞から肝細胞を分化誘導できれば、肝臓移植の代替供給源としての役割を果たすだけでなく、創薬時の毒性スクリーニングにも役立つことが期待されます。
胚発生の過程で、上胚葉細胞(epiblast cell)は順次発生の指示を受け、上皮-間葉転換を経て中胚葉または胚体内胚葉を作ります。ヒトES細胞やヒトiPS細胞から、試験管内で肝細胞様細胞を作製することに成功した研究がいくつかあります。これらの研究のほとんどは、肝細胞としての機能を有する肝細胞様細胞を作製するための効率的な分化プロトコルを開発する方法に焦点を当てています。これらの肝細胞様細胞を作製するための培養条件下では、ヒトES細胞またはヒトiPS細胞は、まず胚体内胚葉に分化させ、次いで時期特異的および組織特異的遺伝子を発現する成熟肝細胞の作製を目指しています。
これまでの研究で、肝細胞増殖因子(hepatocyte growth factor: HGF)ノックアウトマウスは肝臓を発生させることができないことから、HGFは肝臓の発生に必須であることが分かっています。また、HGFとその受容体c-METは細胞増殖、生存、運動性、浸潤、形態形成に関連するいくつかの重要な機能を発揮します。その生理学的機能に加え、HGFは、E-カドヘリンを直接標的とする転写抑制因子であるSnail の発現を増加させることにより、上皮細胞をばらばらにし散在させることが示されています。しかしながら、胚発生過程におけるHGFに関連した分子メカニズムは、まだ十分に解明されていません。
著者らが以前に発表した研究では、HGFとオンコスタチンMを利用した新規の2段階プロトコールにより、in vitroで間葉系幹細胞から肝細胞様細胞を作製することに成功しました。この論文ではそれをさらに発展させ、HGFがアクチビンAシグナルとともに、内胚葉誘導ステップの最初である胚体内胚葉形成を著名に改善し、さらに機能的な肝細胞様細胞をin vitroで作製することができる効率的な3段階分化プロトコルを開発しています。これらの知見は、HGFが肝内胚葉形成における重要な促進因子であり、初期の胚体内胚葉形成における上皮-間葉移行過程に関与していることを示しています。そして最後に、I型糖尿病重症複合免疫不全(NOD-SCID)マウスに四塩化炭素(CCl4)を投与して誘発した致死性劇症肝不全が、iPS細胞由来肝細胞様細胞の脾臓内移植によって改善されることを示しました。
2.方法論
ES細胞やiPS細胞の培養や樹立法、分化誘導法等は、類似した論文の紹介が続きます。比較にも便利と思いますので概要を記載します。
(1)ヒトESおよびiPS細胞の培養
ヒトES細胞株H9(米国国立衛生研究所コード:GE09)およびヒトiPS細胞株CFB4614は、マイトマイシン-C(Sigma-Aldrich、ミズーリ州セントルイス)で増殖能を不活性化したマウス胚線維芽細胞(MEF)フィーダー層上でES細胞培地(ダルベッコ改変イーグル培地[DMEM]/F12 に20%ノックアウト血清置換、10ng/mL塩基性線維芽細胞増殖因子、1mM L-グルタミン、100μM非必須アミノ酸、100μM 2-メルカプトエタノール、50U/mLペニシリン、50mg/mLストレプトマイシン[Invitrogen, Carlsbad, CA]を含む培地で培養しています。分化させる前に、細胞はMEF調整(conditioned)培地を用いて、マトリゲルコートした組織培養ディッシュ上で培養しています。
(2)ヒトiPS細胞のin vitroでの肝細胞様細胞への分化誘導
in vitro分化プロトコールは、著者らの既報の研究およびHayらの研究内容と同様です。簡単に書きますと、ヒトiPS細胞が70%のコンフルエンスに達した時点で、MEF調整培地を100ng/mLのアクチビンA(PeproTech, London, UK)、50ng/mLのWnt3a、10ng/mLのHGF(R&D Systems)を含むRoswell Park Memorial Institute/B27に置き換え、3日間の内胚葉誘導を行っています。次のステップでは、培養液を肝コミットメント培地(ノックアウト血清20%、1mM L-グルタミン、1%非必須アミノ酸、0.1mM 2-メルカプトエタノール、1%ジメチルスルホキシドを含むノックアウト[KO]/DMEM)に交換しています。最後に、成熟ステップとして、細胞は20ng/mLのオンコスタチンM(Invitrogen)、0.5μMのデキサメタゾン、50mg/mLのITSプレミックス(BD Biosciences, San Jose, CA)を添加したイスコーブ(Iscove)改変ダルベッコ培地(IMDM)で培養しています。
(3)動物モデル
5~8週齢のNOD-SCIDマウスをNational Laboratory Animal Center(台湾、台北)から購入しています。NOD-SCIDマウスに対するCCl4の致死性は、経口投与で確認しています。肝細胞様細胞移植は、既報(Kuo et al. Stem cell therapy for liver disease: parameters governing the success of using bone marrow mesenchymal stem cells. Gastroenterology 2008;134:2111-2121)と同様に、CCl4投与24時間後に脾臓内注射で行っています。
(4)フィーダー不要のヒトES細胞培養システムとMEF調整培地によるヒトiPSCの未分化状態の維持
ヒトiPS細胞およびES細胞のコロニーをMEFフィーダー層に数ヶ月間プレーティングし、週1回の継代を行いました。肝分化の前に、マトリゲルコートしたフィーダーフリー培養条件を用いて細胞を継代しました。4日前から0日目にかけての培養で、ヒトiPS細胞とES細胞のコロニーは70%のコンフルエントに達することができ、細胞は、POU5F1としても知られる八量体結合転写因子4(Oct-4)、ステージ特異的胚性抗原4(SSEA-4)、腫瘍拒絶抗原Tra 1-60とTra 1-81等のヒトES細胞表面マーカーの陽性発現を示しました(図1)。これらの結果は、ヒトiPS細胞が肝細胞分化前に多能性を示すことを示しています。
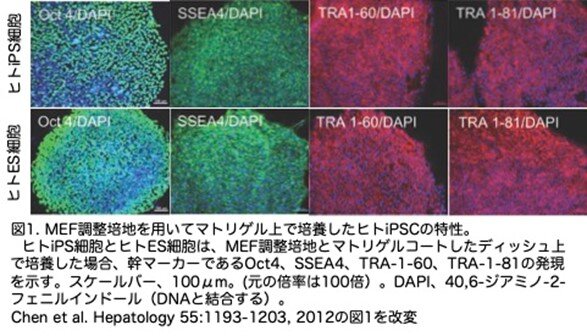
(5)その他の方法
Microarray Gene Expression Analysisについては省略します。
3.in vitroでのヒトiPS細胞から肝細胞様細胞への分化
治療への応用にあたっては、ヒトiPS細胞の分化能を維持することは必須です。著者らは、Hayら(Hay et al. Stem Cells 2008;26:894-902)およびKuoら(Kuo et al. Gastroenterology 2008;134:2111-2121)が記載した培養条件を修正することで、ヒトiPS細胞から肝細胞様細胞を迅速に樹立するための3段階プロトコルを開発しました。
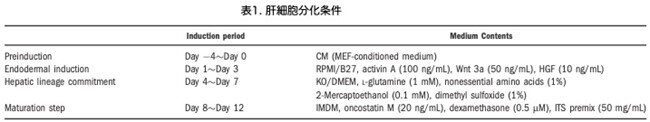
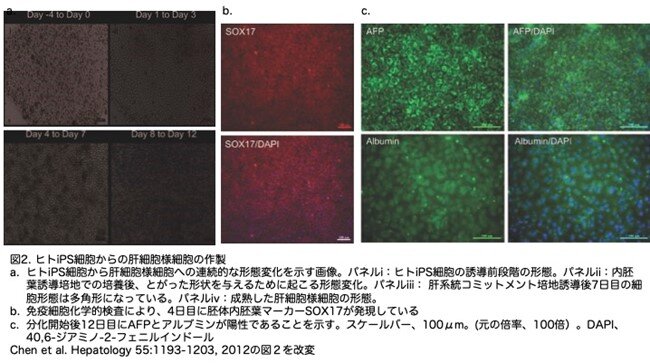
このプロトコールは、「方法論」と表1に記載されています。 ヒトiPS細胞をフィーダー細胞がない培養系で4日間かけて約70%のコンフルエントに到達させた後、ア0日目にクチビンA、Wnt3a、HGFを含む内胚葉誘導培地で培養しています(図2a、パネルi)。これにより、細胞間接触の解離後に生じるES細胞構造の消失が起こり、とがった形状のヒトiPS細胞形態が生じました(図2a、パネルii)。免疫染色の結果、ほとんどの細胞が胚体内胚葉マーカーであるSox17(性決定領域Yボックス17;図2b)に陽性であったことから、ヒトiPS細胞は内胚葉誘導ステップの間に効率よく胚体内胚葉に分化したことが示されました。内胚葉誘導のステップに続いて、細胞を肝細胞コミットメント培地で3日間処理しました。この処理によって、細胞の形態は、とがった形から、細胞間が密着した多角形に変化しました(図2a、パネルⅲ)。最後に培地を成熟培地に変えると、ヒトiPS細胞の形態は立方体に変化しました(図2a、パネルiv)。これらの細胞を免疫組織染色すると、肝細胞様細胞はα-フェトプロテイン(AFP)とアルブミン(ALB)が陽性であることが確認されました(図2c)。
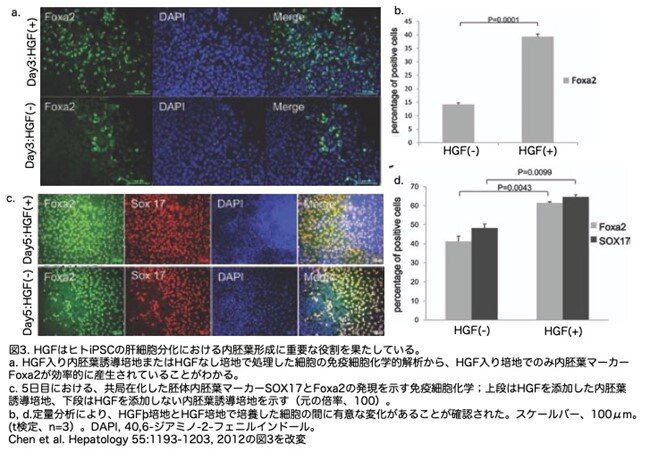
4.肝細胞増殖因子による高効率の内胚葉形成
HGFは培養中の標的細胞に複数の作用を及ぼし、肝臓の発生に関与していることが証明されています。著者らは、HGFがアクチビンAおよびWnt3aと相乗的に作用して、どのように胚体内胚葉形成を促進するかに興味を持ったようです。このプロセスを確認するため、HGFを添加した、あるいは添加しない内胚葉誘導培地でヒトiPS細胞を3日間誘導しました。胚体内胚葉マーカーSox17の発現と一致して、もう一つの内胚葉マーカーであるフォークヘッドボックスa2(Foxa2)が、内胚葉誘導の後に検出されることが観察されました(図3a)。さらに、Foxa2+細胞への分化は、HGF処理を行わなかった場合の14.18%±0.54%と比較して、HGF処理を行った場合は39.35%±0.98%であり、効率が高いことがわかりました(図3b)。HGF処理によって肝系統細胞の形成が増加するかどうかをさらに調べるため、5日目にSox17とFoxa2の発現を調べた結果、Sox17とFoxa2は肝コミットメントの段階で共発現していました(図3c)。内胚葉誘導段階では、HGF無添加群ではFoxa2+細胞が41%、Sox17+細胞が48%でしたが、HGF処理群ではFoxa2+細胞が61%、Sox17+細胞が64%に増加していました(図3c,d)。これらの結果は、HGFが初期の肝細胞系譜への誘導に重要な役割を果たしていることを示唆しています。
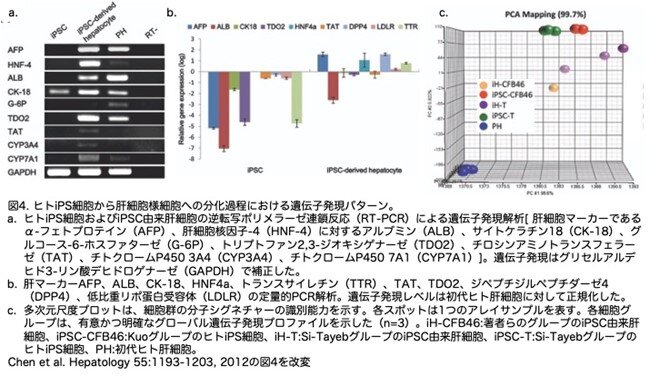
5.iPS細胞由来肝細胞様細胞の遺伝子発現プロファイル
著者らが開発した分化誘導系において、iPS細胞由来肝細胞が成熟した肝細胞の特徴を示すかどうかを確認するため、様々な初期肝マーカー遺伝子の発現パターンを調べました。すなわち、肝細胞核因子4(HNF-4)、アルブミン、サイトケラチン18(CK-18)、グルコース6-リン酸(G-6P)、チトクロームP450 3A4(CYP3A4)、およびチトクロームP450 7A1(CYP7A1)の遺伝子発現パターンを、逆転写ポリメラーゼ連鎖反応(RT-PCR)によって調べました。図 4aに示されたように、これらの遺伝子はすべてiPS細胞由来の肝細胞で発現していました。誘導前後のiPS細胞における肝マーカーの定量的発現レベルを調べるため、定量的PCRで遺伝子発現パターンを確認し、初代ヒト肝細胞のデータと比較した結果、肝遺伝子であるAFP、TDO2、トランスサイレチン(TTR)の発現量は、ヒト初代肝細胞よりもiPSC由来肝細胞の方が有意に高いことが明らかになりました。さらに、iPS細胞とiPS細胞由来肝細胞を比較すると、ALB、サイトケラチン18(CK-18)、HNF-4A、チロシンアミノトランスフェラーゼ(TAT)、低比重リポ蛋白受容体(LDLR)がiPS細胞由来肝細胞でより高発現していることがわかりました(図4b)。著者らのグループのiPS細胞由来肝細胞(オレンジ色のスポット: iH-CFB46)(図4c)とSi-TayebグループのiPS細胞由来肝細胞(紫色のスポット、iH)(図4c)を比較した遺伝子発現マイクロアレイ解析の結果、iPS細胞由来肝細胞は元のiPS細胞(緑色のスポットはiPSC-TでSi-TayebグループのヒトiPS細胞、赤色のスポットはiPSC-CFB46でKuoグループのヒトiPS細胞)(図4c)とは異なり、初代ヒト肝細胞(青色のスポットPH)(図4c)に近いことが示されました。
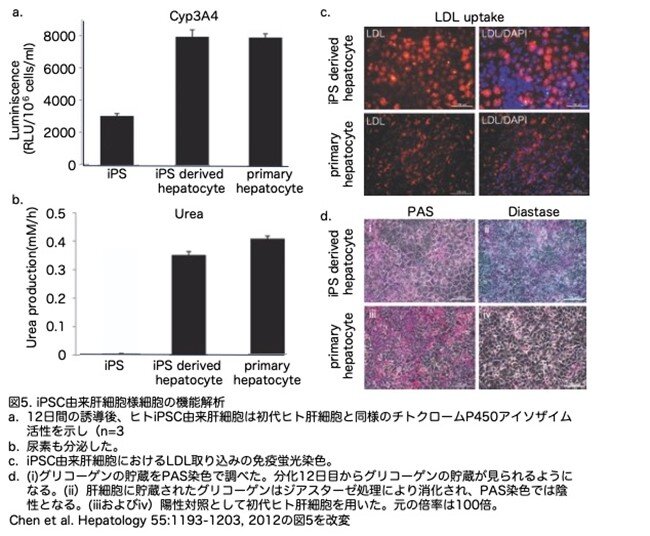
6.ヒトiPS細胞由来肝細胞様細胞の機能評価
ヒトiPS細胞由来肝細胞様細胞の機能を評価するために、その代謝能力を測定しました。シトクロムP450(Cyp)のアイソフォームであるCyp3A4は、肝臓における異種物質の代謝に関与する最も重要な酵素の一つです。分化した肝細胞様細胞はヒト初代肝細胞と同様の CYP3A4 活性を示し、その発現レベルはヒト iPS細胞 よりも著しく高いことが示されました(図 5a)。分化細胞による尿素の分泌も解析し、尿素産生は12日目に検出可能となりました(図5b)。さらに、iPS細胞由来の肝細胞様細胞はLDLの取り込み能力を示しました(図5c)。
iPS細胞由来肝細胞様細胞のグリコーゲン貯蔵機能を確認するために、貯蔵グリコーゲンの存在を過ヨウ素酸シッフ(PAS)染色によって解析した結果、分化した誘導した12日目にグリコーゲンはマゼンタ色に染色され確認できました(図5d、パネルi)。続いてジアスターゼ消化を行ったところ、陽性染色は減少しました。これはマゼンダ染色がグリコーゲンの存在によるものであることを示しています(図5d、パネルii)。なお、陽性対照としてヒト初代肝細胞を用いています(図5d、パネルiiiおよびiv)。
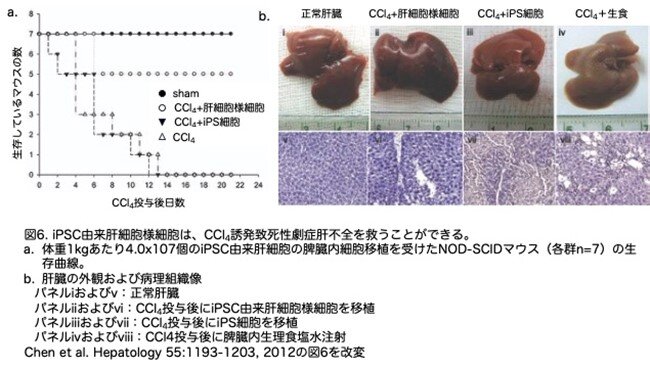
7.iPS細胞由来肝細胞様細胞による致死性劇症肝不全の救出
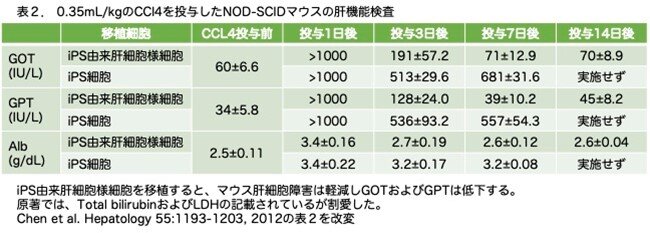
iPS細胞由来肝細胞様細胞が治療に使用可能かどうかを評価するために、NOD-SCIDマウスを用いたCCl4による致死性劇症肝不全モデルを用いました。最適の量である0.35mL/kg体重のCCl4を投与したところ、投与後2週間ですべての動物が死亡しました。体重1kgあたり4.0x107個のiPS細胞を移植しても、レシピエント動物を劇症肝不全から救うことはできませんでした(7匹中0匹が生存)。しかし、体重1kgあたり4.0x107個のiPS細胞由来肝細胞様細胞を移植したマウスでは、71%(7匹中5匹)の動物が劇症肝不全から救済されました(図6a)。CCl4の投与により、病理組織学的解析ではsubmassiveの肝細胞の壊死が確認され(図6b、パネルviii)、生化学的アッセイでは、血清グルタミルオキサロ酢酸アミノトランスフェラーゼ(GOT)、グルタミルピルビン酸アミノトランスフェラーゼ(GPT)、アルブミン(Alb)、総ビリルビン、乳酸脱水素酵素(LDH)などの肝マーカータンパク質のうちGOT、GPT、LDHの上昇からCCl4による急性肝不全の発症が確認されました(表2:総ビリルビンと乳酸脱水素酵素のデータは省略しています)。なお、GOT、GPT、 LDHは上昇しているのに、なぜAlbはあまり変動していないのかという点に気付かれた方もおられると思いますが、これはGOT、GPT、 LDHは肝機能の評価のためのマーカーではなく、肝細胞障害のマーカーで、肝細胞が障害されると細胞内にあった酵素が外に出てくるためです。一方、Albは肝機能のマーカーであり、肝細胞が壊れたからといって上昇するのではなく、肝細胞が絶えず合成し血中に放出されており、いわゆる肝硬変のように肝臓全体の2/3程度の肝細胞が死滅しないと血中Albは低下しないため、肝機能の指標になります。このデータを見るとAlbはほとんど変わっていませんので、肝炎は起こっても全体の肝機能にはまだ余力があるということを示しています。肝壊死はiPS細胞由来肝細胞様細胞の移植では救済されましたが、iPS細胞では救済されませんでした。この結果はコラム第13話番外編1でもお示ししましたように、化学的に誘導された慢性肝疾患が、単離された正常な肝細胞の移植によって、抑制あるいは回復され得ることを示したのと同じ結果であり、コラム第16話ではもっと詳細に解析されています。
8.NOD-SCIDマウスでのiPS細胞由来の肝細胞様細胞の移植と生着
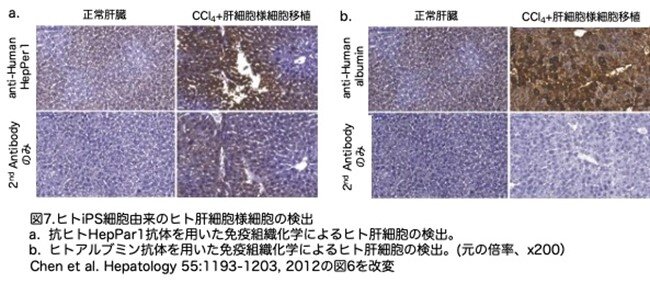
移植細胞がレシピエントの肝実質に生着したかどうかを調べるため、2種類のヒト肝細胞特異的マーカー、HepPar1とアルブミンを用いて、マウス肝臓中のヒト肝細胞の検出を試みています。iPS細胞由来肝細胞様細胞の脾臓内移植によってレスキューされたレシピエントマウスは、移植後28日目に解剖しました。免疫組織化学染色の結果、レシピエント動物の肝実質にはヒトHepPar1(図7a)とアルブミン(図7b)が検出されました。これらのデータは、ヒトiPSC由来肝細胞がレシピエント肝実質に生着したことを示しています。
9.要約と問題点
著者らのプロトコルを用いれば、肝細胞の特徴を示す成熟細胞を迅速かつ効率的に作製することが可能です。Cyp酵素は、薬物代謝やヒト肝臓の代謝全般に関わる重要な酵素です。iPS細胞由来の肝細胞様細胞は、Cypの中で最も重要なCYP3A4の酵素活性を発現しています。このことは、この分化細胞がin vitroモデル薬物スクリーニングに応用できる可能性を強く示唆しています。
今回報告されたiPS細胞から肝細胞様細胞の分化を可能にするin vitro分化システムには、多くの利点があります。第一に、これらの細胞を病気の治療に用いることができると思われます。というのも、この方法はヒトiPS細胞から肝細胞様細胞を作り出していますので、患者の体細胞から再プログラムすることができるからです。第二に、このプロセスは非常に迅速かつ高効率です。著者らのシステムを使えば、ヒトiPS細胞から機能的な肝細胞様細胞への分化に必要な日数はわずか12日ですので、治療プロトコルの開発が容易になります。
結論としましては、ヒトiPS細胞は、3段階のプロトコルを用いることで、迅速かつ効率的に肝細胞様細胞へと分化誘導できることが示されました。iPS細胞由来の肝細胞様細胞の遺伝子発現パターンや機能解析から、本研究は肝細胞分化に関する研究分野も発展させたと考えられます。さらに、分化させた細胞を肝細胞の供給源として利用することで、肝不全患者が肝移植に代わる代替法の開発に役立つことが期待されます。また、肝細胞様細胞を創薬時の毒性スクリーニングに利用できる可能性もあります。
問題点としては、今回の論文もiPS由来の肝細胞様細胞が生着し、CCl4による致死性の肝障害から救出されており、ヒトへの応用が可能となったとは思われますが、残念ながら血清中のヒトAlb濃度が測定されていません。ヒト成熟肝細胞の移植と比較して、iPS由来の肝細胞様細胞がどの程度のAlb産生能力を有するのか、それが示されなかったのは残念です。
次はコラム第16話です
コラム第14話に続き、第15話でもiPS細胞を分化誘導して得た肝細胞様細胞を用いて肝臓ヒト化マウスを作製していますが、やはりこれまでのコラムを読んでいただいた方にとっては、少し物足りないと思われていると思います。次回の第16話では一旦ES細胞に戻ります。第17話で再びiPS細胞由来の肝細胞様細胞に戻ってきますので、お待ちいただけると幸いです。次回は、「Woo et al. Direct and Indirect Contribution of Human Embryonic Stem Cell-Derived Hepatocyte-Like Cells to Liver Repair in Mice.. Gastroenterology 142 602 611 2012」の紹介です。