肝臓ヒト化マウスの歴史 第16話
コラム第16話では、ヒトES細胞由来の肝細胞様細胞(hepatocyte-like cell)を利用した肝臓ヒト化マウス作製の論文を取り上げて説明したいと思います。今回は、「Woo et al. Direct and Indirect Contribution of Human Embryonic Stem Cell-Derived Hepatocyte-Like Cells to Liver Repair in Mice. Gastroenterology 142:602-611, 2012」の紹介です。なお、本論文では補足の方法と補足図が多く、長文となってしまいましたが、非常に興味ある論文でしたので省略せずに紹介します。
1.研究目的と要約
これまで多くの研究が、損傷した組織を細胞で直接に置換することに焦点を当ててきていますが、ドナー細胞由来のシグナルが宿主組織の再生に寄与する能力については、ほとんど知られていません。今まで紹介してきた肝臓ヒト化マウスの論文では、マウス肝臓をヒト肝細胞でどこまで置換できるかに焦点を当ててきました。今回の論文のポイントはそれとは少し違い、傷害を受けた組織や老化した組織の広範な再生を支える、局所的あるいは全身的な可溶性因子の役割に焦点を当てています。つまり幹細胞治療を開発する上で重要なこととして、移植されたドナー細胞が内因性の再生機構とどのように相互作用するかを解析しています。これは肝臓内の損傷を受けた部分を、移植した肝細胞だけで治療しようとするのではなく、内在性の細胞も活用して肝臓を再生しようとするもので、実際の臨床の場で理にかなっています。
組織再生においては、傷ついた組織の機能回復につなげるためには、宿主細胞や移植されたドナー細胞による高度に協調的なイベントが必要です。体内の他の臓器とは異なり、肝臓は比較的短時間でかなりの組織喪失を回復する顕著な能力を持っています。肝臓のこの特徴は、幹細胞由来細胞の移植後の組織修復機構を研究する理想的なモデル系を提供すると思われます。さらに、肝移植の臨床経験から、肝疾患は、幹細胞の生体外増殖を基にした新しい治療法の魅力的なターゲットとなっています。最近、ヒト胚性幹細胞(ES細胞)由来の肝細胞が、肝疾患モデル動物で生存し、肝機能を発揮するという有望な報告がなされました。この報告やこれまでの研究は、ヒトES細胞から肝細胞様細胞を誘導できることを示唆していますが、治療効果をもたらすドナー細胞と宿主細胞のそれぞれの寄与を区別できるような詳細なin vivo解析は行われていません。著者らは、肝再生をモデル系として、ヒトES細胞由来のドナー細胞が、細胞置換のみならず、宿主の傷害組織の内因性再生を支援する栄養因子を供給することによって、組織の回復に積極的に寄与することを示しました。
2.方法論
ES細胞やiPS細胞の培養や樹立法、分化誘導法等は、似たような論文の紹介が続きますが、比較にも便利だと思いますので概要を記載しておきます。
(1)ヒトiPS細胞の樹立と培養
ヒトiPS細胞の作製に用いた親細胞は、Coriell Institute for Medical Research(ニュージャージー州Campden)から入手した培養ヒト線維芽細胞です。サンプルAG20443はパーキンソン病と診断された71歳の男性の皮膚由来で、ヒトiPS細胞株NIHi-11の作製に使用されました。サンプルAG08395は、パーキンソン病と診断された85歳女性の皮膚由来で、ヒトiPS細胞株NIHi-7の作製に使用されました。親細胞は、ヒトOCT3/4、KLF4、SOX2、c-MYCを発現するVSV-G偽型レトロウイルスを用いて、既述の方法で再プログラム(初期化)されました。HepG2細胞(ATCC、メリーランド州ロックビル)は、2 mMグルタミン酸、0.1 mM NEAA、および10% FBS(すべてGibco製)を添加したMEM(Gibco、カリフォルニア州カールスバッド)で培養しています。マウスWnt3a調整培地(mWnt3a-CM)を調製するために、Wnt3a産生L細胞(ATCC)を、0.4μg/mlのG418(Sigma, St Louis, MO)の存在下、100単位/mlのペニシリン/ストレプトマイシン、0.1mMのNEAA、および10%FBSを補充したDMEM中で培養し、その培養液(Wnt3a-CM(Wnt3a-conditioned medium)は、以前に記載されたように調製しました。少量の肝生検サンプルからのヒト肝細胞の単離は、既知の方法と同様に行いました。初代ヒト肝細胞は、100units/mlのペニシリン/ストレプトマイシン、0.1mMのNEAA、および10%のFBSを補充したDMEM(すべてGibco製)で、実験を行う前に24時間維持しました。
(2)ヒトES細胞およびiPS細胞の肝細胞様細胞への分化誘導
内胚葉系細胞や肝細胞系細胞への分化を誘導するため、まずヒトEB(embryoid body)の形成を行っています。その方法は、20%ノックアウト血清置換(KSR、ギブコ)、0.1mM NEAA、0.1mM β-メルカプトエタノールを添加したDMEM/F12培地で、部分的に解離させたヒトES細胞やiPS細胞の塊を培養することで行っています。分化開始の2日後、EBは10mM塩化リチウム(LiCl、Sigma)、1μM GSK-3阻害剤(BIO、Calbiochem)、およびwnt3a-CMの存在下あるいは非存在下のいずれかの条件で増殖させました。誘導から2日後、4日目のEBを誘導因子のない元の培養液に移しました。リチウム処理したEBにおけるWnt/β-カテニンシグナル伝達の活性化と発生能力を、分化開始後4、6、34日目に、遺伝子またはタンパク質の発現を分析することにより解析しました。肝分化を誘導するために、リチウム処理EBを6日目にコラーゲンタイプIコート培養皿にプレーティングし、ITS培地中、20ng/ml HGF(R&D systems, Minneapolis, MN)、および10ng/ml OSMの存在下または非存在下、10-6M DEX(Sigma)の存在下または非存在下で、最大20日間分化させました。
(3)肝機能の生化学的分析
インドシアニングリーン(ICG)溶液(シグマ社製)を、DMEM/F12中に最終濃度1mg/ml ICGで細胞培養に添加しました。細胞を37℃で30分間インキュベートし、PBSで3回洗浄した後、倒立顕微鏡(Axiobert 40 CFL、Zeiss)でICGの細胞内取り込みを調べました。γ-グルタミルトランスペプチダーゼ(GGT)活性は、既述の方法で検出した。ヒトES細胞およびiPS細胞由来肝細胞様細胞のグリコーゲン蓄積は、PAS染色により検出しました。具体的には、細胞を冷やした95% Et-OH中に10%ホルマリンを含む液で固定し、過ヨウ素酸溶液(Sigma)に室温で5分間処理しました。蒸留水で数回洗浄した後、細胞をSchiff試薬(Sigma)で室温で15分間処理し、水道水で5分間洗浄し、ヘマトキシリン(Sigma)で90秒間染色しました。尿素合成を評価するため、ヒトES細胞およびiPS細胞を0~20日間分化後の細胞、HepG2細胞、ヒト初代肝細胞をPBSで洗浄し、500μlの培養液中で48時間インキュベートしました。培地サンプル(20μl)を培養プレートから採取し、市販のキット(Bioassay systems, Hayward, CA)を用いて、メーカーのプロトコールに従って尿素含量を測定しました。吸光度は分光光度計(Libra S22、 Biochrom、Cambridge、UK)を用いて520 nmで測定しました。測定データは、メーカーから提供された標準尿素溶液で算定しました。培養液中のヒトアルブミン濃度を測定するため、ヒトES細胞、iPS細胞、ICG<low>細胞、ICG<high>細胞、HepG2、および初代ヒト肝細胞のコンディショニング液(それぞれ5×104個の細胞から24時間後に回収)を、ヒトアルブミンELISA定量キット(Bethyl laboratories)を用いて、製造元のプロトコールに従って測定しました。
(4)レーザー・マイクロダイセクションおよび圧力カタパルト法
リチウム処理した EB を、20 ng/ml HGF、10 ng/ml OSM、および 10-6 M DEX を添加した 5ml の ITS 培地を含むコラーゲンタイプ I でコートしたPALM® Duplex Dishes に播種しました。PALM MicroLaser System (P.A.L.M. microlaser technologies GmbH, Bernried, Germany)を用いて、20日目にLaser microdissection and pressure catapulting (LMPC)を行いました。マイクロダイセクションの前に、1mg/mlのICG溶液を細胞培養に加え、30分間インキュベートし、分化した肝細胞様細胞にICGを取り込ませました。その後、緑色ICG<high>クラスターをPALM® Duplex Dishesの膜層とともに回収し、標的領域の真上に位置する微量遠心チューブの培地入りキャップ中に注入しました。PALM® Duplex Dishes上に残ったICG<high>クラスターとICG<low>細胞は、上記と同じサプリメントを含むITS培地中に手動でピペッティングし、さらなるアッセイと移植のためにコラーゲンI型コートディッシュに移しました。
(5)蛍光活性化セルソーティング分析
LMPC後、ICG<high>およびICG<low>細胞(1×106個)を蛍光活性化細胞選別(FACS)で分析し、各単離画分の純度を評価しました。細胞内マーカー染色では、細胞を固定し、BD Cytofix/Cytoperm solution(BD Biosciences社製)で透過処理した後、ウサギ抗ヒトアルブミン(Sigma社製)で染色し、続いてFITC標識ヤギ抗マウスIgG(Molecular Probes社製)で染色しました。洗浄後、CellQuestソフトウェア(BD bioscience)を用いてFACS-Caliburで解析しました。
(6)ヒトES細胞由来肝細胞様細胞の移植とモニタリング
5~6週齢の雄のBALB/cヌードマウスに、移植の1日前にCCl4(オリーブ油に10%CCl4を100μl/体重20g)を腹腔内注射しました。移植後の細胞の追跡を可能にするため、単離したICG<high>細胞とICG<low>細胞を、CMVプロモーターの制御下でホタルルシフェラーゼをコードする組換えアデノウイルスベクターで形質導入しました。単離後、細胞(2.0×106個)を麻酔下で脾臓に注入し、コントロール動物には細胞懸濁液に使用した培地を注入しました。その後、Xenogen In Vivo Imaging system(IVIS-200、Alameda、CA)を用いて、移植後7日間にわたって生物発光イメージングを行いました。画像シグナルは、肝臓の予想される領域上に描かれた関心領域(ROI)を通過する光束(光子/秒)を積算することにより定量化しました。移植3日後、肝臓のパラフィン切片を、Alu DNAプローブキット(InnoGenex, San Ramon, CA)を用いたin situハイブリダイゼーションに供し、レシピエント動物でのヒト細胞を検出しました。細胞死は、In Situ Cell Death Detection Kit(Roche, Penzberg, Germany)を用いたターミナルデオキシヌクレオチジルトランスフェラーゼ介在d-UTPニックエンドラベリング(TUNEL)アッセイによって決定しました。移植35日後、移植片の生存率は、宿主動物の血清中のヒトアルブミン濃度をウェスタンブロット分析およびELISAで、肝機能はヒト肝マーカーを免疫組織化学で評価しました。
(7)ナノLC-ESI-MS/MSを用いたsecretome解析
ここで記載された方法はかなり専門的であり不明点がありますがご容赦ください。ICG<high>細胞またはICG<low>細胞(1x106 cells/ml)をマイクロダイセクションした後、コンディショニングメディウムからsecretomeを分手しました。ICG<high>細胞の割合はICG<low>細胞よりもはるかに高いため、ICG<low>細胞は十分な細胞数を得るために凍結ストックから増殖させました。凍結したICG<low>細胞を解凍し、無血清ITS培地に切り替える前に、初期増殖と生存をサポートするため、10%FBSを含むDMEMで24時間インキュベートしました。ICG<high>細胞またはICG<low>細胞をITS培地で48時間インキュベートした後、コンディショニングメディウム(CM)を採取し、分子量10,000カットオフのセントリコンプラス-20フィルター(Millipore, Bedford,MA)で濃縮しました。濃縮培地中のタンパク質をmicroBCATM protein assay kit (PIERCE, Rockford, IL)で定量しました。その後、同量のタンパク質(80μg)をNuPAGE® 4-12% Bis-Tris Gel(Invitrogen, Carlsbad, CA)で電気泳動し分離しました。分離後、ゲルをGelCode® Blue Stain Reagent (Thermo scientific, Rockford, IL)で染色し、各レーン10バンドに切り分けました。ゲル内消化は、12.5 ng/µl sequencing grade modified trypsin (Promega, Madison, WI)を用い、50 mM NH4HCO3 buffer (pH 7.8)中、37℃で一晩行いました。消化後、トリプシンペプチドを50%ACN溶液中5%ギ酸で20分間室温で処理し抽出しました。上清を回収し、SpeedVacで乾燥させました。MS (Mass spectrometry)分析の前に、サンプルをC18 ZipTips (Millipore, MA)を用いて0.1%ギ酸で精製・濃縮しました。トリプシンペプチドは、C18逆相樹脂(5 µm、200 Å)を充填したフューズドシリカマイクロキャピラリーカラム(12 cm x 75 µm)にロードし、LC分離は次のようなリニアグラジエントで行いました(3-40%溶媒B(100%ACN中0.1%ギ酸)グラジエント、流速250nl/min、60分間)。カラムはナノエレクトロスプレーイオン源を備えたLTQリニアイオントラップ質量分析計(ThermoFinnigan, San Jose, CA)に直接接続しました。各フルMSスキャンに続いて、フルMSスキャンの最も強いピークから5番目に強いピークに対応する5つのMS/MSスキャンを行いました。このプロテオミクス用サンプル調製と質量分析手順は、合計3回繰り返しました。取得したLC-ESI-MS/MSフラグメントスペクトルは、BioWorksBrowserTM (version Rev. 3.3.1 SP1, Thermo Fisher Scientific Inc., CA)を用いたSEQUEST検索エンジンにより、National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/) のリバースデータベースを含む非冗長ヒトデータベースと比較し検索しました。検索条件は、トリプシン酵素の特異性、2回の切断ミスに対する許容レベル、ペプチドの許容誤差±2amu、フラグメントイオンの質量誤差±1amu、システインのカルバミドメチル化(+57 Da)とメチオニン残基の酸化(+16 Da)の固定修飾としました。ターゲット-デコイデータベース検索戦略を適用し、偽陽性(FP)率1%のペプチドを選択しました。選択されたペプチドは対応するタンパク質にソートされ、最終的に複数のペプチドがヒットしたタンパク質をさらなる解析に用いました。各サンプル(ICG<high>またはICG<low>-secretome)について、3回の実験を行いました。ICG<high>またはICG<low>サンプルに特異的なタンパク質を同定するために、ラベルフリーのタンパク質定量法を適用しました。ICG<high>およびICG<low>細胞で同定された各タンパク質の相対存在量は、各サンプルについて同定されたペプチド数の正規化比(RSC)を比較することで決定し、log 2スケールで表されたRSC値はICG<high>/ICG<low>の存在量比に変換しました。サンプル特異的タンパク質は、その平均量比が他と比較して少なくとも4倍以上であり、フォールドアバンダンスの変動係数(CV)が0.4未満である場合に特異的であると決定しました。
(8)secretomeの投与
宿主肝再生におけるsecretomeの効果を評価するために、濃縮secretomeをCCl4注射の1日後にマウスに腹腔内に投与しました。肝再生に関与する可溶性因子がペプチドであるかどうかを調べるため、投与前にICG<high>細胞コンディショニング液をトリプシンで消化しました。簡単に説明すると、ICG<high>細胞のコンディショニングメディウムを200μg/mlのトリプシン(Invitrogen)で 37℃、1時間インキュベートしました。その後、sybeanトリプシンインヒビター(Invitrogen、30分、37℃)を添加してトリプシン活性を中和しました。CCl4投与マウスに注入する前に、トリプシン消化コンディショニング培地をセントリコンフィルターユニットで濃縮しました。
(9)新生血管の定量化
CCl4投与後の血管新生の指標として、抗PECAM免疫染色を用いて内皮細胞を標識しました。蛍光画像はZeiss Axiovert 200顕微鏡で撮影し、カラー.jpgファイルとして保存しました。抗PECAM免疫反応性の対象は、ImageJのカスタムマクロ(マクロはリクエストに応じて入手可能)を用いて自動セグメンテーションを行い、面積等を測定しました。すべての画像は同じ撮影パラメータで撮影し、同じ自動化技術で測定し、実験者のバイアスを排除しました。データは、各実験条件における標識物体の平均面積(μm2)で表示しています。
(10)その他の方法
免疫染色と組織学的解析、RT-PCRおよび定量的PCR分析、ウェスタンブロット分析、透過型電子顕微鏡(TEM)、BrdU取り込みアッセイ、ELISAアッセイ、統計解析については省略します。
3.リチウムと成長因子を用いたヒトES細胞の肝細胞への分化
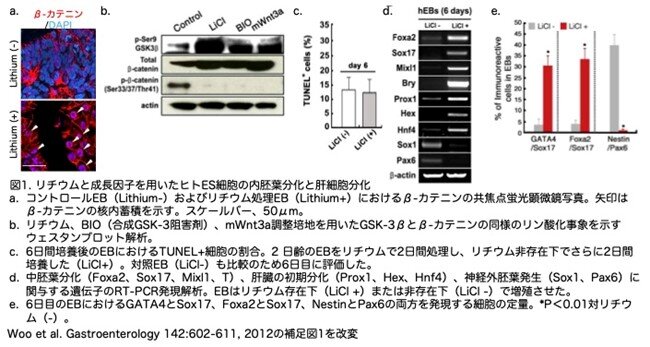
Wnt/β-カテニンシグナル伝達経路は発生中の腸内胚葉(gut endoderm)で活性化され、このシグナル伝達の活性化はES細胞からの中胚葉形成を促進します。リチウムイオンはGSK-3を不活性化し、β-カテニンの安定化と核局在化を促進することが知られています。免疫組織化学的およびウェスタンブロット解析から、ヒトES細胞からEBへ分化開始して2-4日目にリチウムを処理すると、GSK-3が阻害され、β-カテニンシグナル伝達が活性化されることが示されました(図1a, b)。リチウム処理は中程度の細胞死を引き起こしましたが、リチウム非存在下でEB形成をさらに2日間行った後では、リチウム処理したEBと処理していないコントロールEBの間でアポトーシス率に有意差は見られませんでした(図1c)。一方、リチウム処理により、中胚葉および初期肝への運命を促進することが知られている遺伝子(Foxa2、Sox17、Mixl1、T、Prox1、Hex、Hnf4)の発現が増加しました(図1d)。対照的に、神経外胚葉制御因子(Pax6とSox1)の発現は減少しました。凍結EB切片の免疫染色から、神経外胚葉マーカーであるPax6とNestinを共発現する細胞の割合が減少し、GATA4/Sox17とFoxa2/Sox17の二重陽性細胞数がリチウム処理によって増加することが示されました(図1e)。
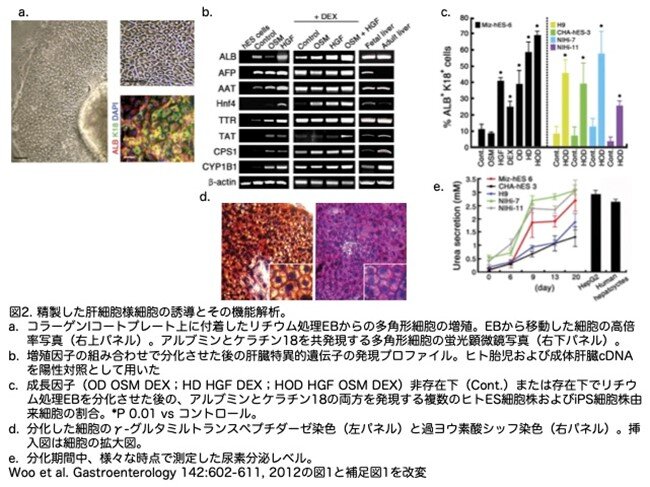
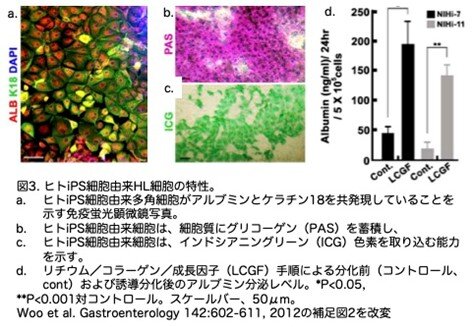
リチウム処理6日後のEBを、HGF、OSM、DEXの存在下でコラーゲンIコートディッシュに置くと、EBから遊走してきた細胞の多くが、明瞭な核を持つ多角形の形態を示し、肝マーカーであるアルブミンとケラチン18を発現しました(図2a)。逆転写ポリメラーゼ連鎖反応解析の結果、3因子すべてが胎児肝臓に見られる遺伝子の発現上昇を誘導するのに必要であることが示されました(図2b)。定量的解析の結果、最大69%±2%(n=5)の細胞がアルブミンとケラチン18の両方を発現し(図2c)、アルブミン陽性細胞の一部(8.1%±0.78%)がα-フェトプロテインを発現しました。胆道マーカーのケラチン7と19を共発現する細胞も観察されました(全細胞の15.3%±1.96%)。成長因子処理に対するアルブミンとケラチン18の共発現は、3つのヒトES細胞株(Miz-hES-6、H9、CHA-hES-3)と2つのヒトiPS細胞株(NIHi-7、NIHi-11;図2c)で再現性よく観察されました。多角形の形態を持つ細胞の多くは、高いグルタミルトランスペプチダーゼ活性とグリコーゲンの蓄積を示しました(図2d)。さらに、成長因子の存在下で細胞が分化するにつれて(6日目以降)、尿素分泌は急速に増加し、HepG2や初代ヒト肝細胞が達成したレベルに匹敵しました(図2e)。iPS細胞に関する詳しいデータは図3を参照してください。
4.肝細胞増殖因子による高効率の内胚葉形成
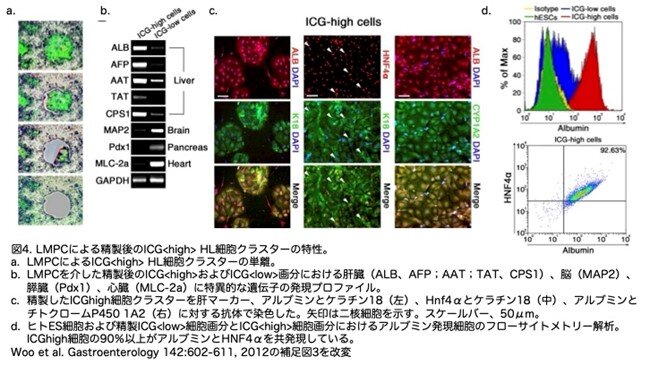
ヒト肝細胞様細胞を同定するために、インドシアニングリーン(ICG)を用いました。ICGは肝細胞によって取り込まれ、排出される有機色素であり、臨床的に肝機能の評価に用いられている無毒性の検査法です。ICGで強く標識された細胞の空間的局在性から、レーザーによるマイクロダイセクションおよび圧力捕捉を用いて、肝細胞様細胞の密度が高い領 域と低い領域(ICG<high>およびICG<low>と命名)から細胞を分離できることが示唆されました(図4a)。レーザー・マイクロダイセクションおよび圧力捕捉後、精製されたICG<high>細胞は肝マーカー(ALB、AFP、AAT、TTR、CPS1)の発現が上昇していました(図4b)。ICG<high>クラスターの細胞のほとんどは、アルブミン/ケラチン18、HNF4/ケラチン18、アルブミン/シトクロムP450 1A2に陽性で、多くの細胞は二核でした(図4c)。フローサイトメトリー解析の結果、精製ICG<high>分画の細胞の90%から92%がアルブミンとHNF4の両方に陽性であったのに対し、ICG<low>細胞ではアルブミンを産生していたのはわずか15.4%でした(図4d)。
加えて、ICG<high>細胞のアルブミン分泌速度(6.6±1.5 g/mL/24 h/106細胞)は、in vitroのHepG2およびヒト肝細胞と同等でした(図5a)。定量的ポリメラーゼ連鎖反応による評価では、ICG<high>細胞ではICG<low>細胞と比較して、アルブミン、薬物代謝の第I相および第II相に関連する酵素であるCYP3A4およびGSTA1/2の転写レベルが すべて亢進していました(図5b)。未分化のES細胞は、電子半透明の未熟なミトコンドリアを含む少数の細胞小器官を持つのに対し、精製したICG<high>細胞は、接合複合体や微絨毛とともに毛細胆管(bile canaliculi)を形成し、細胞質には多数のグリコーゲン顆粒、リポソーム、よく発達したミトコンドリアを含んでいました(図5c, d)。これらの結果は、ICG<high>細胞が正常肝細胞に見られる複数の特徴を発現しており、ICG<low>細胞とは異なることを示す強力な証拠となります。
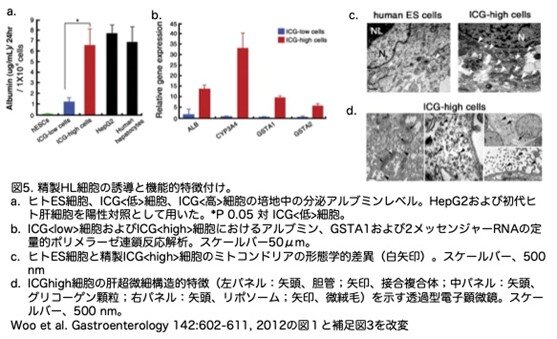
5.生体内におけるICG<high>肝細胞様細胞の移植と機能解析
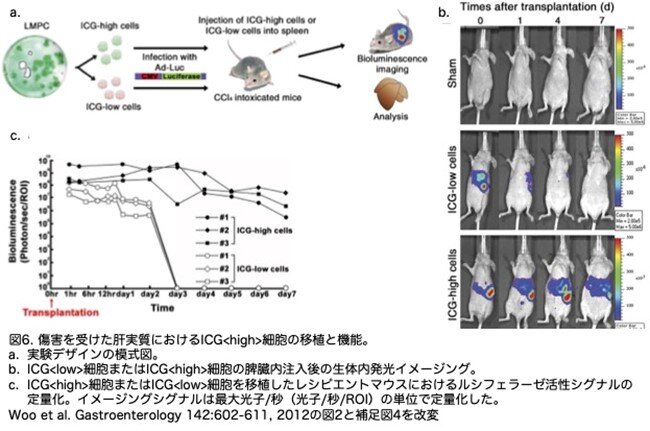
ICG<high>肝細胞様細胞およびICG<low>肝細胞様細胞のin vivoでの分布と生存を非侵襲的に解析するために、CCl4を投与した免疫不全BALB/cマウス(各群n=3)に、ルシフェラーゼ(Ad-luc)を発現するアデノウイルスで形質転換したICG<high>-Ad-lucまたはICG<low>-Ad-luc細胞を脾臓内に移植しました(図6a)。培地を注入したコントロールマウス(Sham)ではルシフェラーゼ発光シグナルは検出できませんでした(図6b)。ICG<low>-Ad-luc細胞の移植は肝臓に発光シグナルを検出しましたが、一過性で移植3日後にはほとんど検出されなくなりました(図6b, c)。一方、ICG<high>-Ad-luc細胞を移植した場合は、移植2時間後に脾臓と門脈領域で強い発光シグナルを示し、7日間保持されました(図6b, c)。移植細胞の生存と機能をさらに解析するために、2回目の実験(コントロールマウス、n=5;ICG<high>細胞、n=8;ICG<low>細胞、n=5)を行いました。移植3日後に組織学的解析により評価したところ、ICG<high>細胞とICG<low>細胞の間に初めて発光シグナルの明確な違いが見られました(図6c)。
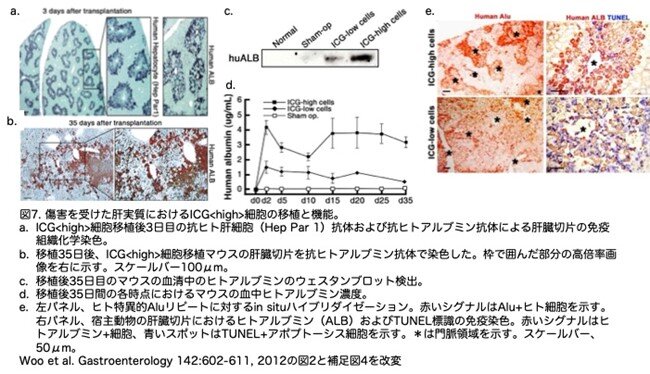
免疫染色とin situハイブリダイゼーションにより、Hep Par1、アルブミン、Alu DNA配列のヒト特異的シグナルが、ICG<high>細胞移植後の門脈周辺に多く分布していることが明らかになりました(図7a, b, e)。ヒトアルブミン陽性領域およびHep Par1陽性領域から推定される平均再生着率は、移植3日目でそれぞれ20.2%±4.45%および23%±1.85%でした。ヒトアルブミンを発現する細胞は、ICG<high>細胞移植後35日目の移植 肝でも検出可能でした(図7b)が、ヒトアルブミン陽性細胞の割合は移植3日目と比較して10.2%±3.11%と低下していました。これらの細胞は、移植3日後にみられた遠心小葉部周囲の放射状パターンではなく、陽性細胞は散在し不連続なクラスターとしてみられた。ヒトアルブミンは、ウェスタンブロットと酵素結合免疫吸着測定法により、移植動物の血清中にも検出されました(図7c, d)。ウェスタンブロットと酵素結合免疫吸着測定法の両方から、ICG<low>細胞で移植した動物はより低いレベルのヒトアルブミンを発現していることが示されました。ICG<低>細胞を移植した肝臓では、シグナルの好発部位は認められませんでしたが、ターミナルデオキシヌクレオチジルトランスフェラーゼを介したデオキシウリジン三リン酸ニック末端標識(TUNEL)陽性(死につつある細胞を意味)細胞の明らかな増加が認められました(図7e)。
6.ICG<high>肝細胞様細胞による宿主肝細胞の増殖と新生血管の促進
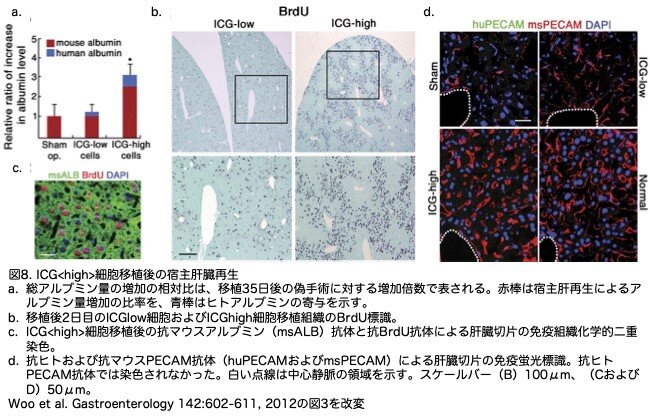
ICG<low>細胞を移植したマウスとShamマウスを35日後に比較すると、自発的なマウス肝臓再生の結果として、アルブミンレベルは上昇し、両者間にほとんど差がありませんでした(図8a)。しかし、興味深いことに、ICG<high>細胞を移植した動物では、他のグループと比較して、血清アルブミンレベルの有意な増加が検出されましたが、ヒトアルブミンの増加はごくわずかでした(図8a)。これらのデータから、ICG<high>細胞は、失われたマウス肝組織を補うだけでなく、内在性の宿主肝組織の再生をサポートする役割を担っている可能性が示唆されました。宿主肝再生における移植ICG<high>細胞の寄与の可能性を検討するため、移植後の初期段階における宿主細胞とドナー細胞の増殖を評価しました。以前の研究で、肝細胞へのブロモデオキシウリジン(BrdU)の取り込みは、CCl4投与後2-3日でピークに達することが示されています。ICG<high>細胞の移植により、2日後にICG<low>細胞と比較して増殖する細胞数を大幅に増加させました(図8b)。BrdU陽性細胞の大部分は、移植細胞が濃縮された中心小葉領域から離れており(図8b)、マウスアルブミン陽性であった(図8c)ことから、多くの増殖細胞は宿主肝細胞であることが示されました。類洞血管網の回復は、肝再生に不可欠なもう一つの側面です。ICG<high>肝細胞様細胞移植肝の血管内皮細胞密度は、ShamおよびICG<low>細胞移植群に比べ、非常に増加していました(図8d)。ヒトPECAM陽性細胞はICG<high>細胞移植群でもICG<low>細胞移植群でも検出されなかったことから、ヒトES細胞由来細胞は新しい血管系に統合されなかったことが示されました(と書いてありますが、ヒト肝細胞様細胞は内皮細胞には分化できないだけかもしれません)。
7.ICG<high>肝細胞様細胞Secretomeの宿主細胞増殖と新生血管への影響
まずタイトルにあるSecretomeですが、この「-ome」というのは「全体」を意味する言葉ですので、secretomeというのは分泌された蛋白全体という意味になります。
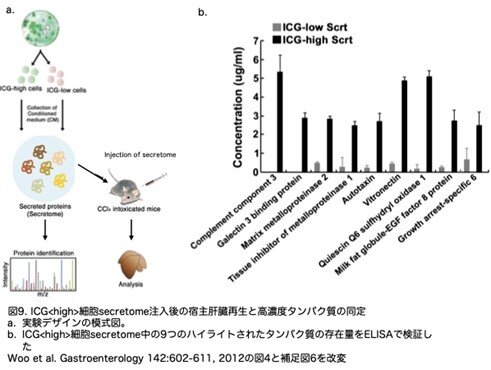
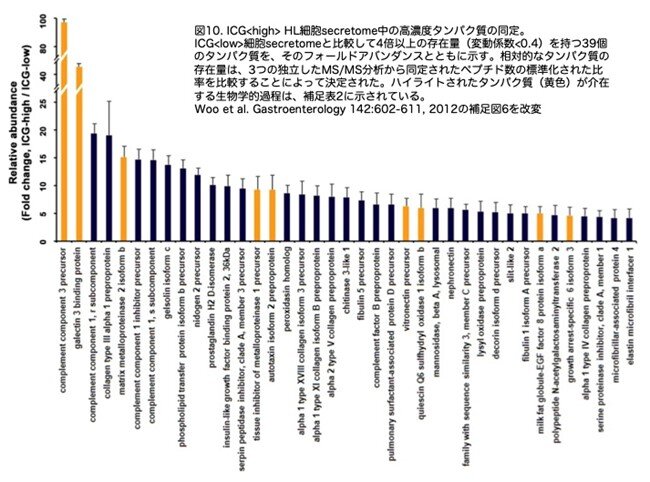
肝再生は、多くの細胞タイプの相互作用を媒介する複数の成長因子やサイトカインによって刺激されます。したがって、ICG<high>肝細胞様細胞は、宿主肝細胞の増殖と新生血管形成をサポートする可溶性因子を放出する可能性があると考えられました。この可能性を探るため、ICG<high>およびICG<low>細胞調整培地から得られた分泌プロテオーム(secretome)を、ラベルフリー定量質量分析システム(nano-LC-ESI-MS/MS;図9a)を用いて分析しました。オントロジー解析の結果、ICG<high>細胞のsecretome(199タンパク質、論文の補足表1に表示されていますが省略します)の92%が分泌タンパク質に分類され、その分泌タンパク質の90%は正常肝臓または再生肝臓で産生されていることが分かりました。独立した3つのタンデム質量分析から得られたタンパク質の存在比を定量し、ICG<high>細胞のsecretomeにおいてICG<low>細胞のsecretomeの4倍以上の濃度の39種類のタンパク質を同定しています(図10)。ICG<high>肝細胞様細胞の濃縮されたsecretomeには、再生肝細胞の増殖反応、新生血管、壊死組織のクリアランス、細胞外マトリックスのリモデリングを調節することにより、肝臓再生をサポートする可能性のある候補分子が含まれていました。これらのタンパク質の濃度をELISA法を用いて検証したところ、すべてICG<high>細胞のsecretome中 に高度に濃縮されていることが示されました(39種類のうち9種類のデータを図9bに示しています)。
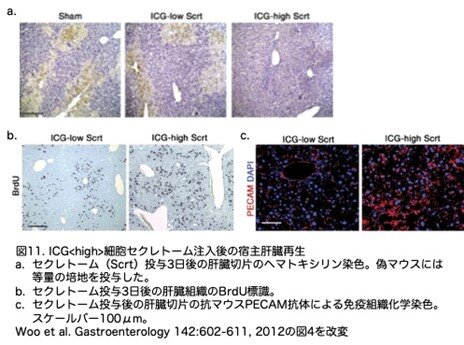
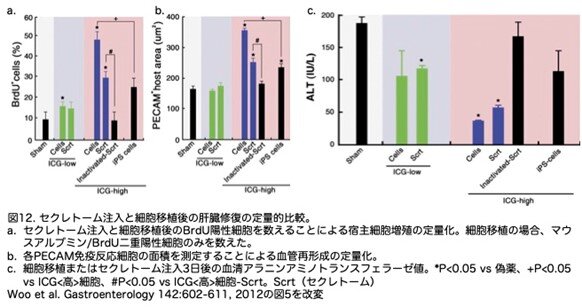
これらの知見から、ICG<high>細胞secretomeが、細胞移植なしに宿主の再生反応を促進するかどうかを解析しました。細胞移植を行わずにICG<high>細胞secretome(方法論の箇所に書きましたが、ICG<high>細胞を培養したときのコンディショニング液の投与です)だけを3日間投与したところ、大きな壊死領域を伴う顕著な肝臓病変が著しく減少しました(図11a)。さらに、宿主肝細胞の増殖と血管新生もともに有意に促進されました(図11b, c, 図12a, b)。ICG<high>細胞の分泌物をトリプシン消化すると、再生活性は完全に消失しました。興味深いことに、傷害を受けた宿主組織はICG<high> iPS細胞由来肝細胞様細胞に対して穏やかな再生反応を示しました。ICG<high>細胞secretomeを投与したときの宿主の再生反応は、ICG<high>肝細胞様細胞を移植したときの反応よりも低いものでした(図12a, b、青いバー)。しかし、ICG<low>肝細胞様細胞の移植とそのsecretome投与時には宿主の再生反応の差は見られませんでした(図12a, b、緑色のバー)。これらの結果と一致して、ICG<high>肝細胞様細胞またはsecretomeを投与したときの血清中ア ラニンアミノトランスフェラーゼのレベルは最も低くなり、トリプシン消化secretome投与後には有意な減少は認められませんでした(図12c)。
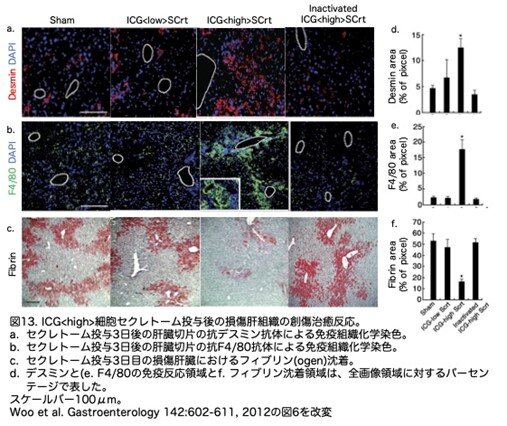
8.肝創傷治癒におけるICG<high>肝細胞様細胞secretomeの効果
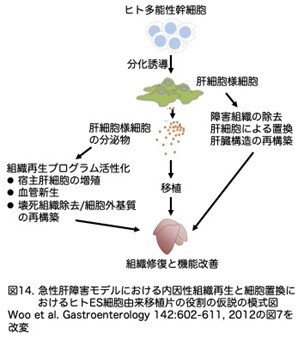
正常な肝構造の回復は、肝細胞と類洞内皮細胞、肝星状細胞(HSC)、クッパー細胞などの非実質細胞との複雑な相互作用に依存しています。免疫染色から、傷害部位へのデスミン陽性造血幹細胞とF4/80陽性マクロファージの侵入が、ICG <high>細胞secretomeを注入された肝臓で著しく増加していることが明らかになりました(図13a, b, d, e)。さらに、傷害を受けた壊死部位のフィブリンクリアランスは、ICG <high>細胞secretomeの投与によって著しく有意に促進されましたが、フィブリンの沈着はsecretome注入3日後の他の治療では明らかでありませんでした(図13c, f)。いずれ の場合も、ICG<high>細胞secretomeはトリプシン消化後に活性を失いました。これらのデータを総合すると、ヒトES細胞由来のICG<high>肝細胞様細胞は、肝細胞置換そのものだけでなく、肝臓再生に必要な内因性組織修復プログラムを促進する栄養因子を放出することにより、肝機能を改善する可能 性があることが強く示唆されました(図14)。
9.要約と問題点
この論文ではこれまでのヒト化肝臓マウスの論文とは違う観点で行われ書かれています。コラム第13話番外編1で紹介した論文「Laconi et al. Carcinogenesis 16:139-142, 1995)」と共通するものがあります。すなわち「正常肝細胞を移植すると、巨大細胞症や胆管増殖など、ラットの肝臓でピロリジンアルカロイド投与によって誘発される慢性的な変化の発生を、ほぼ完全に抑制することができた」との記載があります。つまり本論文と同じで、肝臓の内在性の再生を促進しているという論文です。少し長くなりますが、示唆に富む議論が展開されていますので、紹介しておきたいと思います。
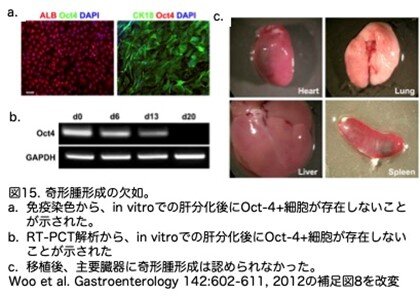
これまでの研究では、ヒトES細胞やiPS細胞から肝細胞様細胞を作製することが報告されており、もっぱら移植細胞自体の肝機能の検証に焦点が当てられてきました。本研究では、ヒト多能性幹細胞由来細胞の直接的および間接的な治療的役割について調べています。急性肝障害のモデルを用いて、ICG染色とレーザー・マイクロダイセクションおよび圧力捕捉によって得られた肝細胞様細胞が、効率的に生着し、肝機能を発現し続けることが示されています。ICG<high>肝細胞様細胞のサブセットがα-フェト蛋白を発現していることを考慮すると、これらの細胞は未熟な胎児肝細胞の性質を持っている可能性があり、移植後、より機能的な表現型を獲得するためにはさらなる成熟過程が必要であると思われます。以前の移植研究では、ヒトES細胞由来の肝細胞の移植後に腫瘍形成の高い発生率が報告されました(Basma H, Soto-Gutierrez A, Yannam GR, et al. Differentiation and
transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology 2009;136:990-999)。この研究では、一連の移植肝や他の主要臓器に腫瘍形成の徴候は見られていません(図15)。しかしながら、ヒトES細胞由来ICG<high>肝細胞様細胞の機能と安全性を評価するためには、さらに長期的な研究を続ける必要があります。
肝臓の再生と再増殖の研究には、代謝や遺伝的欠損を持つさまざまな動物モデルが用いられてきました。CCl4による傷害は、長期的な肝臓再増殖の研究には理想的なモデルではないかもしれませんが、このモデルはよく研究されており、再生プログラムの初期段階を研究するのに広く用いられています。部分肝切除のような物理的傷害と比較すると、CCl4による毒性傷害は、肝細胞増殖に加えて、細胞死や炎症を含む広範な再生反応を誘導します。中心葉の傷害は7-10日で消失しますが、動物の遺伝的背景によってCCl4誘発肝傷害に有意な差が見られ、BALB/cは最も感受性が高く、組織学的回復が長引く(3週間)ことが示されています。本研究では、このモデル系における肝臓再生の初期段階に注目し、ICG<high>肝細胞様細胞が宿主肝細胞の増殖と再灌流を強く促進し、アラニンアミノトランスフェラーゼ値を顕著に低下させることを明らかにしました。この再生反応は、トランスジェニックAlb-uPAマウスやレトロシン投与マウスではほとんど観察できていません。多分、これらの動物モデルでは、宿主本来の肝細胞の増殖が損なわれているか、ブロックされているからだと思われます。
この研究で示された非常に重要な点は、傷害を受けた組織に対して、肝細胞様細胞を移植することなく、肝細胞様細胞のsecretomeを投与することで、宿主組織の有意な再生が達成されうるという直接的な証拠を提供したことです。さらに、プロテオーム解析を用いて、肝細胞様細胞から分泌され、内因性の宿主組織修復を促進する可能性のある候補タンパク質を同定しています。濃縮された分泌物には、成長停止特異的6(GAS-6)、補体成分3、オートタキシン、ビトロネクチン、マトリックスメタロプロテアーゼ2、組織メタロプロテアーゼ阻害剤1などがあり、これらはすべて肝臓再生の修復過程に寄与しているという報告があります。その他の興味深いタンパク質として、キエシンQ6スルフヒドリルオキシダーゼ1(QSOX1)と乳脂肪球-EGF因子8(MFGE-8)が同定されました。QSOX1はErv/ALR(Augmenter of Liver Regeneration)と名付けられたドメインを持ち、急性および慢性肝障害後に高発現し、肝細胞増殖を促進します。もう一つのタンパク質、MFGE-8(ラクタヘドリンとも呼ばれる)は、傷害部位の死細胞の貪食除去に寄与し、肺線維症を減少させることが知られています。さらに、このタンパク質は腸管損傷後の治癒過程で重要な役割を果たし、血管の成長を促進します。本論文では、血管内皮増殖因子A(VEGF-A)をICG<high細胞分泌物から低レベルで検出しています(データは示されていません)。しかし、このレベルはICG<low>細胞secretomeで観察されたレベルと有意差がなかったことから、VEGF-Aは新生血管形成に寄与する主要なプレーヤーではないことが示唆されました。一方で、MFGE-8が成体の病的新生血管形成過程におけるVEGF血管新生作用の重要なメディエーターであることが最近報告されました。VEGFの濃度は肝再生中の組織で著しく上昇することから、ICG<high>分泌物に豊富に含まれるMFGE-8が、著者らの系においてVEGF依存性の新生血管形成を促進する可能性が考えられます。QSOX1とMFGF-8の短縮型(SED-1、N末端Notch様II型上皮成長因子反復とC末端discoidin/F5/8 Cドメインを含む分泌タンパク質)の発現は、最近、再生肝臓や正常肝臓で検出されましたが、肝臓修復におけるそれらの役割は今のところ不明です。したがって、肝再生におけるこれらのタンパク質の役割を探ることは、非常に興味深く感じられます。
造血幹細胞の活性化が持続すると肝線維化を引き起こしますが、造血幹細胞はHGFと細胞外マトリックスを分泌し、正常な肝構造の回復をサポートすることで、肝再生を開始する中心的な役割を果たしています。ICG<high>肝細胞様細胞のsecretomeから検出されたGAS-6は、肝マイトジェンおよび単球走化性タンパク質1を放出するクッパー細胞の強力な活性化因子です。GAS-6が急性肝障害後のクッパー細胞を活性化することによって、造血幹細胞の傷害部位への浸潤に重要な役割を果たしていることが既に示されています。これらの知見と同様に、著者らのデータは、ICG<high>肝細胞様細胞分泌物が造血幹細胞だけでなくマクロファージの集積を促進し、CCl4損傷肝の中心葉領域における壊死病変を減少させることを示唆しています。
肝臓の修復に貢献するもう一つの可能性は、secretomeの抗アポトーシス機能であると思われます。肝細胞様細胞の分泌物は、CCl4による細胞死を防ぐことによって間接的に増殖細胞数を増加させ、最終的に肝臓の修復に寄与する可能性があります。実際、肝細胞様細胞分泌液にはゲルソリンが含まれており、このゲルソリンは劇症肝不全におけるアポトーシスを抑制することが以前から知られていました。secretomeにおける再生シグナルの同定とその分子メカニズムは、今後の興味深い研究課題であり、統合的なアプローチが必要と思われます。
次はコラム第17話です
コラム第14話と第15話ではiPS細胞を分化誘導して得た肝細胞様細胞を用いた肝臓ヒト化マウス作製に関してお話しました。今回は、ヒトES細胞由来の肝細胞様細胞を用いての話題でした。次回の第17話は「Nagamoto et al. Efficient Engraftment of Human Induced Pluripotent Stem Cell-Derived Hepatocyte-Like Cells in uPA/SCID Mice by Overexpression of FNK, a Bcl-xL Mutant Gene. Cell Transplantation, 24:1127-1138, 2015」を紹介します。再びiPS細胞由来の肝細胞様細胞についてご紹介しますので、お待ちいただけると幸いです。