肝臓ヒト化マウスの歴史 第18話
ヒトiPS細胞由来の肝細胞を用いた肝臓ヒト化マウスの作製
コラム第14話、第15話、第17話ではiPS細胞を分化誘導して得た肝細胞様細胞を用いて、第16話はヒトES細胞由来の肝細胞様細胞を用いて肝臓ヒト化マウスを作製に関する話題でした。前回も述べましたが、細胞レベルではmRNAレベルの発現レベルは同じで免疫組織染色でも十分染色されるため、一見良さそうですが、血中ALB濃度という成体レベルで肝臓としてのその機能を調べると、いずれもprimary human hepatocyte (PHH)の結果よりはずっと悪い(24μg/mL対7800μg/mLで0.3%)ものでした。今回の第18話は、多能性幹細胞を介さず、体細胞(線維芽細胞)からリプログラミングにより直接誘導した肝細胞を利用した論文で、「Du et al. Human Hepatocytes with Drug Metabolic Function Induced from Fibroblasts by Lineage Reprogramming. Cell Stem Cell 14: 394-403, 2014」を紹介します。
1.研究目的
機能的なヒト細胞タイプは、再生医療や医薬品開発の分野で高い需要があります。これらの細胞は、病的組織や損傷組織の修復や置換に大きな可能性を有し、医薬応用のための貴重なツールとなります。しかし、ドナー不足のため、機能的ヒト細胞型の応用は限られています。この点を解決するために、機能的に成熟した細胞を作製するための新しい方法の開発が強く求められています。最近、体細胞の運命を変える効果的な方法として、細胞系譜初期化(lineage reprogramming)が登場しました。原理的には、ある細胞型は別の細胞型の最終的な成熟状態に直接転換することができるようになり、機能的なヒト細胞の有望な供給源となる可能性があります。
機能的ヒト肝細胞は、薬物代謝を評価するための最も重要なin vitroモデルであり、医薬品開発に広く応用できる可能性があります。創薬における新規化合物の失敗の主な原因は、肝臓における予想外の代謝および毒性作用です。ヒト肝臓に最も近いin vitroモデルとして機能するヒト肝細胞を、吸収・分布・代謝・排泄・毒性(ADME/Tox)のアッセイにおいて使用することは、化合物を選別するために不可欠です。 現在、医薬品開発においては、異なる遺伝的背景を持つ個体由来の初代ヒト肝細胞が頻繁に使用されています。この結果、遺伝的背景が多様であるため、これらの細胞を用いた医薬品研究から得られる結果の再現性が得られにくい状況にあります。さらに、ヒト肝ドナーの不足は、初代ヒト肝細胞の使用を大きく制限しており、創薬に使用するためには、再現性の高いヒト肝細胞の代替資源が早急に必要とされています。
機能的肝細胞を作製するために様々な方法が開発されてきましたが、一つの方法は、ヒト多能性幹細胞から誘導する方法です。この方法は近年急速に進歩していますが、多能性幹細胞由来の肝細胞様細胞の表現型が未熟であることが技術的な障害となっています。肝細胞形成においては複数の重要なステップが含まれるため、原理的に、この方法を用いて完全に機能する肝細胞を得ることは比較的困難と思われます。対照的に、細胞系譜初期化法では、初期化させた幹細胞を経ることなく、別の体細胞への細胞系譜転換が可能です。ただし、すでにマウスの肝細胞は線維芽細胞から分化転換されているものの、これらの細胞は依然としてα-フェトプロテイン(AFP)などのいくつかの肝芽細胞マーカーを発現しており、薬物代謝を担ういくつかの重要なチトクロームP450酵素(CYP)の発現を欠いていることから、これらの細胞の表現型が機能的に未熟であることが示唆されています。
本研究では、成熟因子 (maturation factor)とともに肝細胞運命転換因子(hepatic fate conversion factor)を異所的に発現させることで、線維芽細胞から機能的なヒト肝細胞を作製することを試みました。この方法により、薬物代謝機能を有し、医薬品開発に応用可能なヒト誘導性肝細胞(human induced hepatocyte: hiHeps)を簡便かつ再現性よく作製することができました。
2.方法論
(1)ヒト一次肝細胞の分離と培養
本研究は、中国日本友好病院の臨床研究倫理委員会(倫理承認番号:2009-50)および研究監督委員会(SCRO201103-03)により承認され、ヘルシンキ宣言の原則に従って実施されました。ヒト胚胎皮膚および妊娠14週目の胎児肝組織は、患者から同意を得た中絶組織から取得しました。胎児肝細胞は、以前に報告された方法に従って取得しました。胎児肝組織は、1-3 mm³の断片に切り分け、10 mlの培地(RPMI 1640)にコラーゲンゼーIV(Gibco)1 mg/mlを添加した培地で消化しました。消化は37℃で15~20分間行い、赤血球は低速遠心分離で除去、細胞はRPMI 1640培地で3回洗浄されました。トリパンブルー排斥法により、細胞の生存率は90%と推定しました。ヒト一次肝細胞は、肝移植に使用されないヒトドナー肝臓から、インフォームドコンセントを得て分離し、HCM(LONZA)で培養しました。
(2)成長曲線と倍加時間
MTTアッセイでは、増殖期と成熟期の誘導細胞を96ウェルプレート(1ウェルあたり1,000細胞)に播種し、p53 siRNA-GFPサイレンシング前(HCM)またはp53 siRNA-GFPサイレンシング後(改変WEM)の培地でそれぞれ7日間培養しました。MTTアッセイは、メーカーの指示に従って毎日実施しました(Vybrant® MTT Cell Proliferation Assay Kit, Invitrogen)。なおMTTアッセイとは、細胞の増殖、活性および毒性を調べるために広く用いられている方法で、細胞内に取り込まれたMTT〔3-(4, 5-ジメチル-チアゾール-2-イル)-2, 5-ジフェニルテトラゾリウムブロマイド〕は、ミトコンドリアにある脱水素酵素により還元され、ホルマザン色素が生じます。色素量は代謝活性のある細胞数と相関するため、これを比色法(吸光度570nm)で定量することにより、生細胞数を測定できます。増殖期の誘導細胞の倍加時間を算出するため、p53 siRNA-GFPサイレンシング前の増殖期の誘導細胞を、1ウェルあたり30,000細胞の密度でマトリゲルコーティングされた12ウェルプレートに播種し、培養しました。増殖率は、ヘマサイトメーターを使用して時間経過に伴う細胞数を測定することで決定しました。成長の指数関数的段階のデータ(12、24、36、48時間時点のデータポイント)を用いて指数関数的成長曲線を作成しました。倍加時間(Td)は、以下の式を用いて算出しました。
Td = t * ln2 / ln(Nt/N0)
※ここで、Ntは時間tにおける細胞数、N0は初期時点における細胞数です。
(3)hiHepsの樹立
ヒト線維芽細胞は一晩感染させ、DMEMに10%胎児牛血清を加えた培地で1週間培養した後、HCM(Lonza)に移し替えて増殖させました。3週間の培養後、HCMは改変William's E培地(北京ヴィタルスターバイオテクノロジー)に置き換えました。
(4)動物と移植
BALB/c系統のTet-uPA/Rag2-/-/γc-/-マウスは、北京ヴィタルスターバイオテクノロジーから購入しました。hiHeps、ES-Heps、およびヒト肝細胞(2×10⁶細胞/動物)をマウスの脾臓に注射しました。血液サンプルを採取し、ヒトアルブミンはBethyl LaboratoriesのHuman Albumin ELISA Quantitationキットを使用して定量しました。受容体マウスの肝臓はOCT化合物(Sakura)に埋め込み、液体窒素で凍結しました。クライオスタット切片(10 μm)を染色しました。
(5)肝細胞分化
ヒト胚性幹細胞(hESCs、ES細胞株H1、WiCell研究所)は、照射処理したマウス胚性線維芽細胞上でhESCs培養液(Thomsonら、1998)を用いて維持しました。hESCsは、以前に報告された方法(Zhaoら、2013)に従って肝細胞へ分化させました。
(6)肝細胞分化
分子クローニング、レンチウイルス生産およびトランスダクション、CYP代謝アッセイ、アルブミンELISA、PAS染色、ICGの取り込みと放出、LDLの取り込みとオイルレッド染色、RNA-Seq解析、免疫蛍光法とフローサイトメトリー解析、毒性試験、Statistical Analysisについては省略します。
3.肝細胞に関連する略称について
本論文では、幹細胞と関連した略称が、これまで紹介してきた他の論文と違う点がありますので、まとめて表1に示しました。

4.肝細胞の運命を誘導する因子の同定
ヒト胚線維芽細胞(HEF)を肝細胞に誘導する転写因子の組み合わせを同定するために、ヒト肝細胞で発現し、肝細胞の運命決定に重要であることが既に示されている転写因子のうち、オンラインで入手可能なもの(表2)を選別しました。
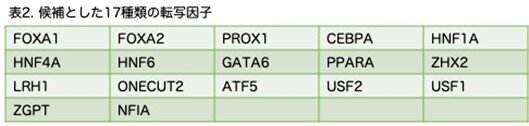
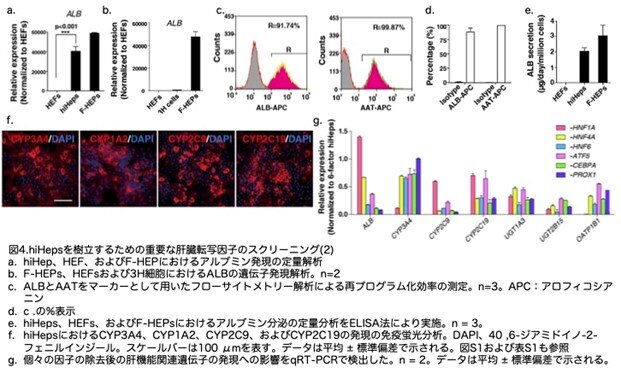
以前の研究では、増殖停止と細胞死が細胞の初期化するときの一般的な障壁であることが示されています。したがって、初期化プロセスでは増殖促進が期待できるMYCと細胞死に関与するp53を阻害するため低分子干渉RNA(siRNA)を用いました(図1a)。さらに、HNF1AとHNF4Aは、17の転写因子の中で胚と成体の肝臓の両方で重要な役割を担っているため、優先的に選択しました。次に、HNF1AとHNF4Aの組み合わせに候補因子を1つずつ加える『2+1』戦略を用いて、追加因子をスクリーニングしました。その結果、HNF6が、HNF1AおよびHNF4Aと協力して、細胞は20日以内に増殖し(図1b)、ALBUMIN(ALB)陽性細胞を高率に誘導することがわかりました(図1c)。この3つを3因子と呼び、これらにより誘導された肝細胞様細胞(3H細胞)は、グリコーゲン合成や低密度リポタンパク質(LDL)の取り込みなど、いくつかの肝特性を示しました(図1d, e)。しかしながら、これらの細胞におけるALBの発現は極めて低いレベルでした(図1f)。さらに、肝細胞における主要なチトクロームP450酵素の発現は検出されませんでした (図1g)。したがって、3H細胞は機能的に未成熟であり、その完全な成熟にはさらなる因子が必要であることが示唆されました。
5.成熟した肝細胞を生成する因子の同定
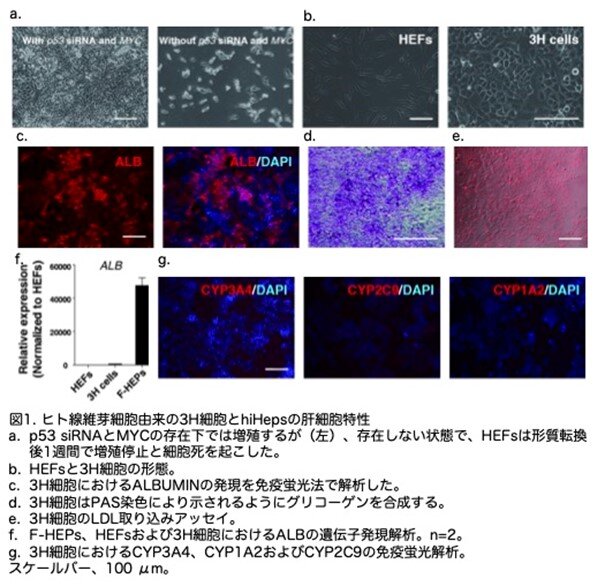
肝細胞様細胞の機能的成熟を誘導する因子を同定するため、3H細胞、新鮮に分離したヒト一次肝細胞(F-HEP)、および胎児肝細胞(HEF)において全遺伝子発現解析を実施しました。CEBPA、ATF5、PROX1を含む複数の肝転写因子の発現に、3つのサンプル間で差が観察されました。これらの3つの遺伝子は、F-HEPと比較して、3H細胞およびHEFでは相対的に低い発現レベルを示しました。この差は、定量PCRによりさらに確認できました(図2a)。これらの遺伝子のうち、PROX1は著者らの前回の研究で、肝細胞の代謝成熟に不可欠な主要な転写因子であることが示されています。CEBPAとATF5は肝臓に特異的に高発現する転写因子であり、肝機能発現において重要であることを示唆しています。さらに、遺伝子発現研究では、これら3つの遺伝子がF-HEPsで高発現していることが示されました(図2b)。これらのデータにより、3因子の過剰発現により3H細胞の機能的成熟化が促進される可能性が示唆されました。
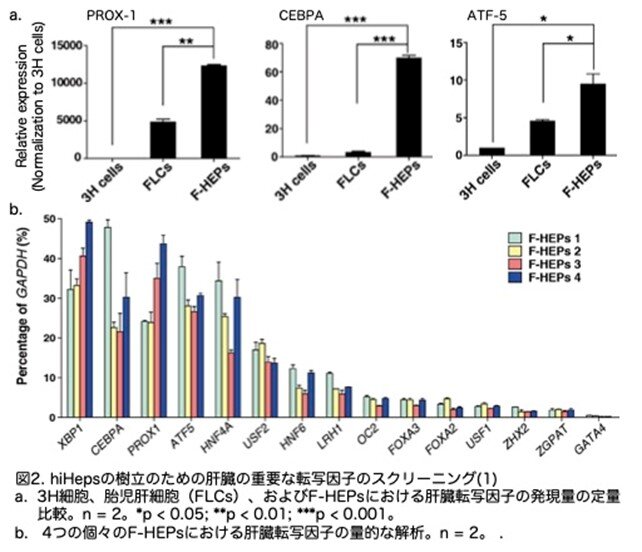
そこで、線維芽細胞から成熟したヒト肝細胞を誘導するため、CEBPA、PROX1、およびATF5の3つの因子の効果を解析しました。HEFsにおいてこれらの因子を過剰発現させた結果、線維芽細胞が上皮細胞へと1週間で劇的な形態変化を遂げることを観察できました。これらの細胞は肝細胞培養液(HCM)中で急速に増殖し、倍加時間は9~11時間でした(図3a)。感染後2週間で、再播種された細胞は一次ヒト肝細胞の典型的な形態を示しました(図3b, c)。感染後約25日目に、p53 siRNAはGFPレポーターにより示されたように抑制され(図3d)、誘導された細胞を改変されたWilliam's E培地に移行しました。
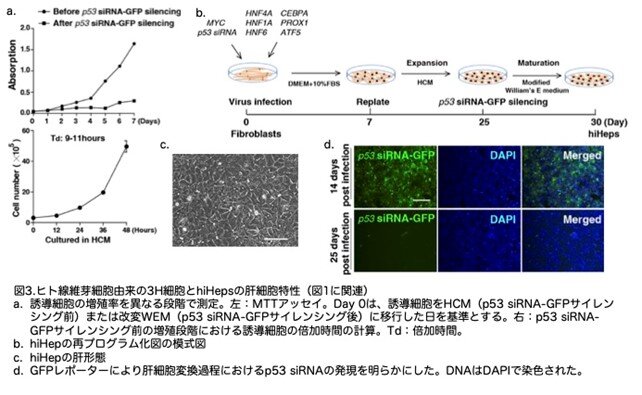
定量PCRの結果、誘導された肝細胞様細胞は、一次ヒト肝細胞と同等のレベルでALBを発現しており(図4a)、3H細胞よりも有意に高い発現でした(図4b)。さらに、再プログラム効率を分析した結果、誘導された細胞の90%がALB陽性であり、ほぼ100%がα-1アンチトリプシン(AAT)陽性でした(図4c,d)。ALBの分泌は劇的に増加し、一次ヒト肝細胞と同等のレベル に達していました(図4e)。さらに、4つの主要なシトクロムP450酵素(CYP3A4、CYP1A2、CYP2C9、CYP2C19)も、免疫染色により誘導細胞で発現が検出されました(図4f)。これらの 6つの因子のいずれかを除去すると、薬物代謝酵素および輸送体の発現が大幅に減少しました(図4g)。これらの結果から、誘導された肝細胞様細胞において機能的な肝細胞の特性が見出され、これをhiHepsと命名しました。
6.hiHepで見られるヒト肝細胞の典型的な特徴
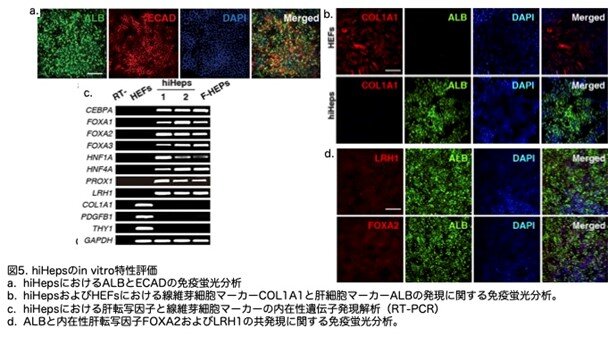
肝細胞への分化転換を評価するため、まず典型的な肝細胞の特徴を分析しました。免疫蛍光顕微鏡観察により、上皮マーカーのE-cadherin(ECAD)がhiHepsにおいてALBと共発現していることが確認されました(図5a)。さらに、線維芽細胞マーカーのCOL1A1は検出されませんでした(図5b)。これらの結果は、hiHepsにおける間葉-上皮移行の成立を示して います。次に、hiHepsにおける内在性肝転写ネットワークの活性化をさらに検討しました。RT-PCRの結果、FOXA1、FOXA2、およびFOXA3(Zaret et al., 2008)の内在性発現が活性化されていることが示されました(図5c)。肝臓の相互調節ネットワークに関与する別のコア転写因子であるLRH1(Nagaoka and Duncan, 2010)も、hiHepsにおいて内在的に発現していました(図5c)。FOXA2とLRH1の発現は、免疫蛍光法で確認され(図5d)、さらに、COL1A1、PDGFRB、およびTHY1を含む線維芽細胞マーカー遺伝子は、hiHepsでは検出されませんでした(図5c)。
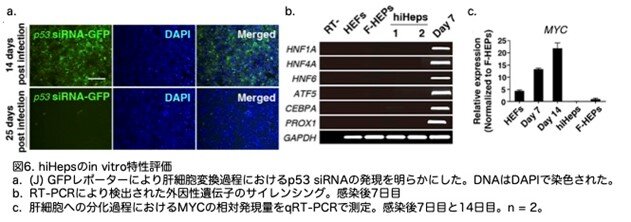
p53 siRNAによるサイレンシング(図6a)に一致して、hiHepsにおいてHNF1A、HNF6、HNF4A、ATF5、PROX1、およびCEBPAの外因性発現がサイレンシングされていることをさらに確認しました(図6b)。さらに、定量RT-PCR(qRT-PCR)により、MYCの発現レベルが新鮮に分離したヒト一次肝細胞よりも低下していることが示されました(図6c)。これらのデータは、hiHepsが肝転写ネットワークを獲得したことを示しています。
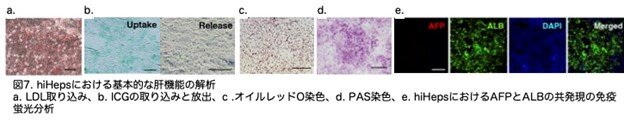
次に、hiHepsのヒト肝細胞の機能的特性を評価しました。hiHepsはLDLの取り込み能を有していました(図7a:2E)。また、hiHepsは培地からインドシアニングリーン(ICG)を取り込み、培地を除去した後、吸収したICGを排除する能力も確認されました(図7b:2F)。hiHepsにおけるオイルレッドO染色では脂肪滴の蓄積が観察され、ペルオキシド酸-シフ(PAS)染色ではグリコーゲン合成が示されました(図7c,d:2Gおよび2H)。F-HEPと同様に、hiHepsはAFP陰性でした(図7e:S2C)。
Gバンド分析では、培養7週間後のhiHepsが正常な染色体構成を有することが示されました(図8)。
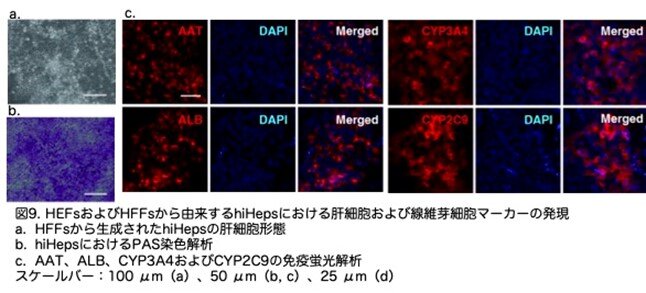
HEFsに加え、同じ因子を用いてヒト成人包皮線維芽細胞を転換し、同様の結果を得ました(図9a,b,c)。これらの結果は、hiHepsが典型的な肝機能的特性を示すことを示しています。
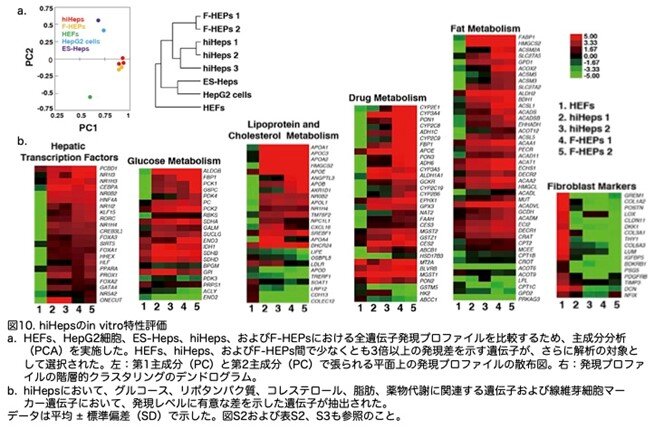
著者らは、RNAシーケンスによりhiHepsとF-HEPsの全遺伝子発現パターンを比較しました。主成分分析と階層的クラスタリング分析の結果、異なるドナーから樹立されたhiHepsはヒト肝細胞とクラスタリングされ、ヒト線維芽細胞、HepG2細胞、およびヒト胚性幹細胞(ESC)由来の肝細胞(ES-Heps)から区別されました(図10a)。実際、hiHepsでは肝転写因子の発現が上昇し、線維芽細胞特異的遺伝子の発現が低下していました(図10b)。さらに、hiHepsは、リポタンパク質、コレステロール、脂肪、グルコース、および薬物代謝に関連する一連の遺伝子において、肝細胞の遺伝子発現パターンを示していました(図10b)。これらの結果から、hiHepsは一次ヒト肝細胞と類似した発現プロファイルを示すことが示されました。
7.hiHepsにおける薬物代謝中央ネットワークの確立
hiHepsが薬物代謝の主要な酵素を発現しているかどうかを評価するため、hiHepsにおける5つの主要なCYP酵素(CYP1A2、CYP2B6、CYP2C9、CYP2C19、およびCYP3A4)の発現を定量的に確認しました。これら5つの主要なCYPは、ヒトの薬物 酸化の60%を占める主要な第1相酵素です(Zhou et al., 2009)。陽性対照として、5人の個人ドナーから得たプールされたF-HEPsを使用しました。注目すべきは、これらの主要なCYPのmRNAレベルは、hiHepsとF-HEPsで類似していたのに対し、ヒトES細胞由来の肝細胞やHepG2細胞での発現とは異なることが示されました(図11a)。
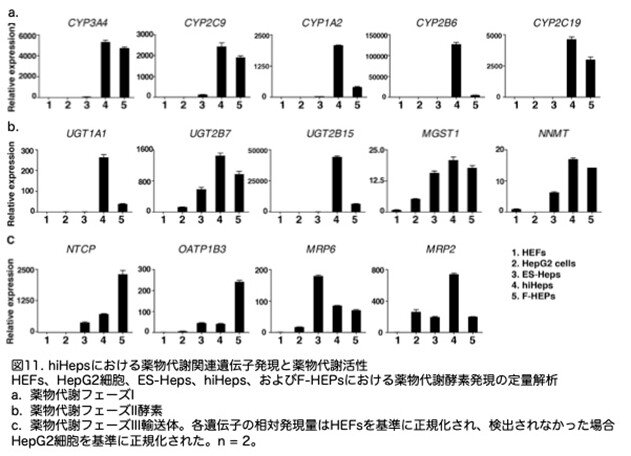
次に、hiHepsにおいて、異物薬物の排泄に重要な役割を果たす第II相酵素と第III相輸送体の存在を分析しました。これらの遺伝子の発現レベルはF-HEPsと類似していました(図11b,c, 図12a)。さらに、hiHepsは広範な第I相および第II相代謝酵素ならびに第III相輸送体を発現していました(図12b)。これらの結果から、hiHepsにおいて薬物代謝の中核ネットワークが適切に確立され、新鮮に分離したヒト肝細胞のプールと類似していることが示唆されました。
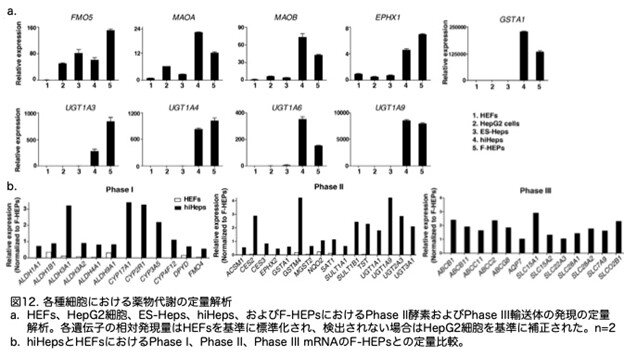
8.hiHepsにおける主要な薬物代謝活性レベルはF-HEPと同等
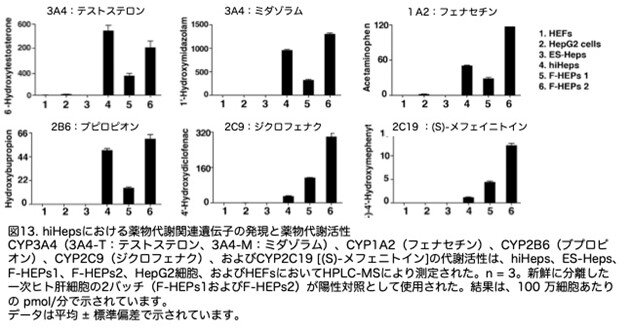
hiHepsの薬物代謝活性を評価するため、まずCYP3A4に焦点を当てました。超高速液体クロマトグラフィー-タンデム質量分析法技術を用い、テストステロンとミダゾラムという構造的に異なる2つの基質を用いて、hiHepsにおけるCYP3A4の薬物代謝活性を検討しました。薬物クリアランスの個人間変動が著しいことから、新鮮に分離した一次ヒト肝細胞の2バッチを陽性対照として使用しました。HepG2細胞株、ES-Heps、およびHEFsとは対照的に、hiHepsは2つのCYP3A4選択的基質をF-HEPsと同程度の効率で代謝することができました(図13:3D)。さらに、hiHepsにおけるCYP1A2とCYP2B6の代謝活性はF-HEPsとほぼ同等でした(図13:3D)。hiHepsにおけるCYP2C9とCYP2C19の活性は、F-HEPsの約30%でした(図13:3D)。hiHepsにおけるこれらのすべてのCYP酵素の代謝活性は、ES-Hepsの少なくとも100倍以上でした。これらのデータは、hiHepsが新鮮に分離されたヒト一次肝細胞とほぼ同等の主要なCYP酵素の代謝活性を示すことを示しています。
hiHepsにおける薬物代謝の機能的中心ネットワークをさらに評価するため、hiHepsとF-HEPsにおける核受容体の発現を比較しました。これらの核受容体は、代謝酵素の発現を調節する上で重要な役割を果たしています。異物代謝系を担当する核受容体は、hiHepsにおいて発現していました(図14a:S3C)。さらに、hiHepsはCYP3A4、CYP1A2、およびCYP2B6の標準的な誘導剤に対してmRNAレベルで応答しました(図14b:S3D)。これらのデータから、hiHepsにおいて核受容体ネットワークの機能的確立が示唆されます。
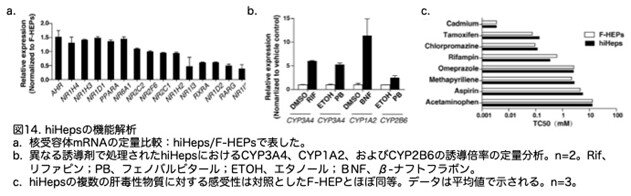
hiHepsの肝毒性研究への応用可能性を評価するため、モデル肝毒性の急性毒性を定量化しました。肝毒性は、薬剤の臨床試験失敗の最も一般的な有害事象である(Sahi et al., 2010)ため、薬剤毒性の感受性は、ヒト肝細胞を薬剤開発に適用する上で重要な指標です。hiHepsは、一連のモデル肝毒性物質と培養した際に、一次ヒト肝細胞と同等の感受性を示しました(図14c:S3E)。これにより、hiHepsを薬剤毒性試験に用いる可能性が示唆されました。
9.Tet-uPA/Rag2-/-/γc-/- マウス肝臓へのhiHepsの再生着
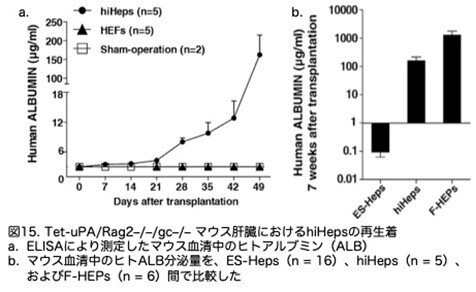
hiHepsがマウス肝臓を再生着する能力を調査するため、Tet-uPA(ウロキナーゼ型プラスミノーゲン活性化因子)/Rag2-/-/γc-/- マウスにhiHepsを脾内に移植しました(Song et al., 2009)。マウス血清中のヒトアルブミンの分泌量は徐々に増加し、hiHep移植後7週目で最高値の313 μg/mlに達しました(図15a,b,c:4A-4C)。これはES-Hepsの1,000倍であり、一次ヒト肝細胞とほぼ同等でした(図15b:4B)。
移植効率を分析するため、2匹のマウスの全肝から肝細胞を分離し、フローサイトメトリー解析で測定したところ、313 μg/mlのヒトALBUMINを分泌したマウスにおける再生着率は約30%でした(図16:4C)。hiHep移 植後2ヶ月で腫瘍形成は観察されませんでした。
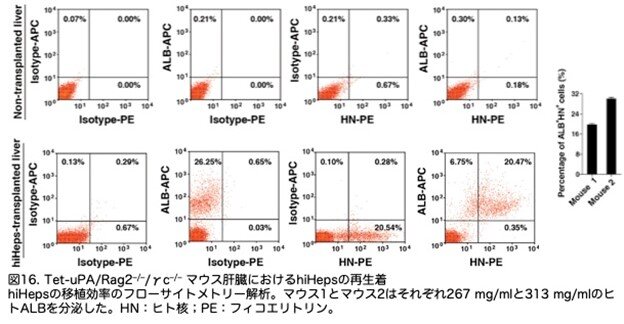
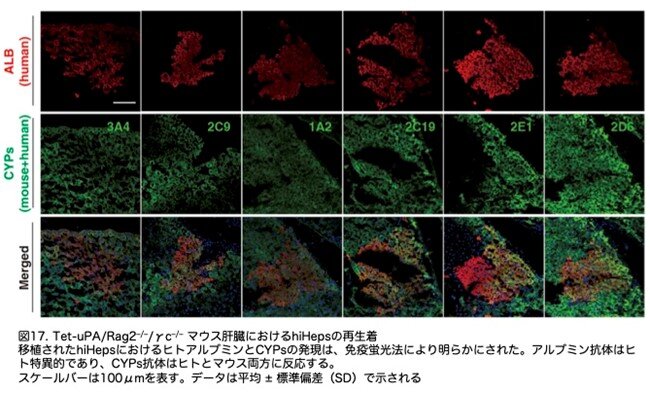
hiHepsの移植片も分析しました。移植後6週間で、受容体マウスにおいてヒトALBを発現する細胞のクラスターが観察されました(図17:4D)。hiHepsのin vivo代謝機能を検証するため、CYPの発現を解析したところ、CYP3A4、CYP2C9、CYP1A2、CYP2E1、CYP2C19、およびCYP2D6を含む主要なCYPの発現(図17:4D)は、hiHepsがin vivoで依然として機能的であることが示されました。これらの結果を総合すると、hiHepsはTet-uPA//Rag2-/-/γc-/- マウスの肝臓を強力に再構築し、生体内で機能していたことが示唆されました。
10.要約と問題点
この論文では、HEFsから肝細胞運命転換因子HNF1A、HNF4A、HNF6と成熟因子ATF5、PROX1、CEBPAを組み合わせることで、ヒトhiHepsが容易かつ再現性よく作製できることが示されました。ヒトの初代肝細胞と同様に、hiHepsは上皮形態、肝細胞特異的マーカーの発現、肝細胞の基本的な機能特性、および全遺伝子発現パターンを含む多くの典型的な肝細胞の特徴を示しています。重要な点として、hiHepsでは、第I相および第II相の薬物代謝酵素と第III相の薬物輸送体の包括的なスペクトルが確立されていることです。さらに、移植されたhiHepsは、Tet-uPA/Rag2-/-/γc-/-マウス肝臓の最大30%を再構築し、in vivoで300 μg/mlを超えるヒトアルブミンを分泌します。したがって、線維芽細胞から薬物代謝機能を有するヒト肝細胞を細胞系譜再プログラム化により誘導できるという強い証拠が得られました。
細胞系譜再プログラム化における重要な課題の一つは、完全に機能する細胞をどのように獲得するかです。線維芽細胞において肝細胞運命決定因子を発現させることにより、主要な肝細胞特性を有するマウス誘導性肝細胞様細胞が樹立されています。しかし、hiHepsにおける不完全な肝細胞分化と特定の肝芽細胞マーカーの発現は、未熟な状態または前駆細胞様状態と一致しています。本研究では、特定の肝細胞運命決定因子がHEFsを肝細胞様細胞に再プログラム化できることを確認しました。しかし、これらの細胞は、追加の3つの因子を添加するまで機能しませんでした。追加の3つの因子は、hiHepsのさらなる代謝成熟を促進します。この現象は、肝細胞運命決定と肝細胞機能成熟が異なるマスター遺伝子によって制御され、互いにある程度独立している可能性を示唆しています。完全に機能的な細胞を得るためには、細胞運命決定因子の異所性発現だけでは不十分であり、追加の機能成熟因子が不可欠であることを示しました。
ヒト肝細胞の薬物代謝能力は、肝細胞を他の細胞系と区別する最も重要な機能の一つであり、薬物開発において広範な応用可能性を有しています。ヒト多能性幹細胞を肝細胞へ分化させる試みは、機能的に未熟な細胞を生じさせてきました。本研究グループは、以前ヒトES-HepsがCYP1A2とCYP3A4を発現することを示しました。しかし、これらの2つのCYP酵素の活性は、一次肝細胞に比べて著しく低いものでした。別の研究では、分化させた肝細胞のCYP3A4とCYP1A2の活性は、培養された一次肝細胞の活性とほぼ同等でした。しかし、培養された一次肝細胞では、時間経過とともに肝機能に不可欠な機能が徐々に失われていきます。本研究では、すべての標準である新鮮に分離した一次ヒト肝細胞を陽性対照として使用しました。我々のhiHepsは、一次ヒト肝細胞とほぼ同等のレベルで、主要な第I相(CYP3A4、CYP2C9、CYP2C19、CYP2B6、およびCYP1A2)および第II相の薬物代謝酵素、ならびに第III相の薬物輸送体を発現しています。重要な点として、hiHepsにおける5つのCYP酵素の代謝活性は、新鮮に分離したヒト肝細胞におけるものと同等であり、これらのCYP酵素によって代謝される薬物の評価におけるhiHepsの応用可能性を示唆しています。
これらの細胞において、外来性物質代謝系に関連する内在性核受容体の発現を検出することができました。さらに、標準的な誘導剤によりCYP3A4、CYP1A2、およびCYP2B6の発現が上昇しました。さらに、肝細胞における統合された代謝経路(フェーズIおよびフェーズII酵素、フェーズIII薬物輸送体)は薬物発見において極めて重要であるため、hiHepsの薬物代謝ネットワークを詳細に解析しました。薬物代謝マーカーをコードする遺伝子の発現パターンは、初代ヒト肝細胞と類似しており、hiHepsにおける薬物代謝ネットワークの高度な上昇を示唆しています。これらの結果は、hiHepsにおいて機能的な薬物代謝の中核ネットワークが確立されていることを示しており、これらの細胞は前臨床スクリーニングアッセイの有望な代替手段となる可能性があります。
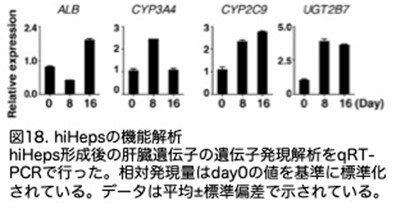
ヒト肝細胞の薬物開発におけるもう1つの重要な特徴は、薬物毒性に対する感受性です。ヒト多能性幹細胞から由来したヒト肝細胞は、薬物毒性に対する感受性が比較的低いことが報告されています。本研究では、hiHepsの複数のモデル肝毒性物質に対する感受性は、初代ヒト肝細胞のそれと同等でした。これは、hiHepsが新規薬物発見における肝毒性試験における貴重な代替細胞資源となる可能性を示唆しています。重要な点として、本研究により、誘導細胞が早期段階で大規模に増殖可能であること、hiHepsの機能は16日間維持されることが確認されたことです(図18)。再プログラム効率を考慮すると、線維芽細胞10⁴個から10¹¹個以上の機能的なhiHepsを得ることができます。これらの結果は、hiHepsが医薬品開発において実践的な用途に活用できることを示唆しています。
肝細胞移植は、同種肝移植に代わる有望な代替療法です。しかし、高品質な細胞を提供できるドナー臓器の供給不足は、依然として大きな課題となっています。本研究では、hiHepsはマウス肝臓で十分に再生着し、最大313 μg/mlのヒトアルブミンを分泌しました。これは、ヒト胚性幹細胞由来のヒト肝細胞を用いた最近の研究に比べて2桁高い値です。さらに、移植されたhiHepsは主要なCYP酵素を発現していましたが、これはhiHepsが体内で薬物代謝機能を維持していることを示唆しています。総合的に、hiHepsはヒト化肝臓マウスモデルや肝細胞移植の確立における重要な細胞源となる可能性があります。
結論として、私たちは細胞運命決定因子と細胞成熟因子の共同発現により、薬物代謝機能を有するヒト肝細胞を産生しました。この戦略は、多様な機能性細胞タイプの産生に向けた根本的な解決策を創出する可能性があります。肝成熟因子の組み合わせのさらなる最適化により、将来的にはhiHepsの完全な機能的成熟を実現する可能性が高いと考えられます。細胞系譜再プログラム化による機能的なヒト肝細胞の産生は、医薬品応用向けに再現性があり機能的なヒト肝細胞を産生する手段を提供できると思われます。
本コラムにおける図のまとめ方について
最近の論文では、実験内容が多くなり、本論文の文章と図表以外に、結論を補強するためのsupplementary materialsとして、追加の方法論と数多くの図表が掲載されています。今回に限らずコラムで取り上げた原著論文を読まれたかたは、図が違うと思われる方もいるかもしれません。このコラムの目的は専門家でなくても読みやすいものにするため、supplementary materialsのみならず他の論文内容も紹介しています。今回の論文ではsupplementary materialsが多く、本文中にも「Figure S1A」というように、正式な図表と入り乱れて登場します。読む方からすると、supplementary materialsもその都度見る必要があり、行ったり来たりして論文を読み進める必要があります。この分野の研究者で読みづらいのに、ましてや専門外の人にとっては読み上げるのに相当時間がかかっていると思います。そこで、本コラムでは本文中の図とsupplementary materialsの図を区別せず、出てきた順に並べることにしました。いざやってみると相当煩わしいもので苦労しました。どのくらい入り乱れているかいるのかを示すために、コラムでの図の番号と論文での図の番号を対応させたものを、表3に示しました。
次はコラム第18話番外編です
コラム第14話、第15話、第17話ではiPS細胞を分化誘導して得た肝細胞様細胞を用いて、第16話はヒトES細胞由来の肝細胞様細胞を用いて、そして第18話は、多能性幹細胞を介さず、体細胞(線維芽細胞)からのリプログラミングにより直接誘導した肝細胞様細胞を用いて肝臓ヒト化マウスを作製に関する話題でした。肝臓ヒト化マウスを作製したときの血中ヒトALBをここで比較しておきたいと思います。表3に初代ヒト肝細胞を、表4に多能性幹細胞または体細胞から直接誘導した肝細胞様細胞を用いて、肝臓ヒト化マウスを作製した場合の血中ヒトALBのデータの一覧を作ってみました。結果は一目瞭然で、前者では10mg/dLに達するものあるのに対し(表4)、後者では多能性幹細胞由来だとせいぜい0.24%の24μg/mLそして今回紹介した体細胞から直接誘導した肝細胞様 細胞では3.13%の313μg/mLでした(表5)。

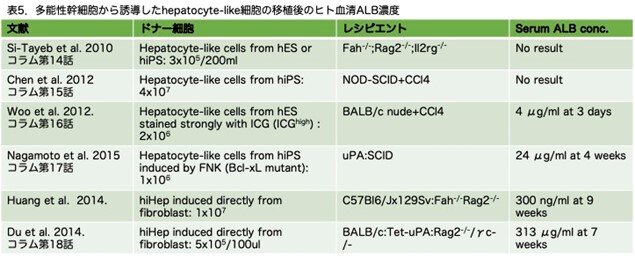
この点は今回の論文で明確に述べられており、多能性幹細胞由来だと実用化にはまだ程遠いものがあります。日本の多能性幹細胞を用いた再生医療の報道を見ていると、いたずらに浮かれて伝えていることが多く、その後の経緯を正確に伝えているのはあまり見たことがなく、誤った印象を我々に与えている様に思います。いたずらに浮かれるのではなく、この論文のような冷静な判断が必要と思います。次回は、ヒト初代肝細胞に戻りますが、紹介を忘れていましたので第18話番外編として「Bissig et al. Repopulation of adult and neonatal mice with human hepatocytes: A chimeric animal model. Proc. Natl. Acad. Sci. USA. 104:20507-20511, 2007」を紹介します。