肝臓ヒト化マウスの歴史 第17話
ヒトiPS細胞由来の肝細胞を用いた肝臓ヒト化マウスの作製
コラム第17話では、ヒトiPS細胞由来の肝細胞様細胞(hepatocyte-like cell:HLC)を利用した肝臓ヒト化マウス作製の論文で、「Nagamoto et al. Efficient Engraftment of Human Induced Pluripotent Stem Cell-Derived Hepatocyte-Like Cells in uPA/SCID Mice by Overexpression of FNK, a Bcl-xL Mutant Gene. Cell Transplantation, 24:1127-1138, 2015」の紹介です。本論文では、iPS由来のHepatocyte-like cell (iPSC-HLC)が、初代ヒト肝細胞(primary human hepatocyte: PHH)と比較してどの程度肝細胞として成熟しているのかについて議論しています。肝臓細胞に限らず、iPSから多くの分化細胞が誘導されていますが、それらが本当に臨床の場で十分使える機能を有しているかという論点は非常に重要です。しかしながら、それがきちんと議論されている論文は意外に少ないのが現状です。この点に注目してお読みいただきたいと思います。
1.研究目的
ヒト肝臓キメラマウスは、薬物毒性試験や肝炎ウイルス研究における強力なツールです。最近、ヒト多能性幹細胞(ヒト胚性幹細胞(ESCs)および誘導多能性幹細胞(iPSCs)から分化させたヒト肝細胞様細胞(HLCs)の移植により、ヒト肝臓キメラマウスを樹立したとの報告が複数あります。しかし、これまでの報告において、ヒトES/iPSC由来のHLCs(ES/iPSC-HLCs)を有するヒト肝臓キメラマウスの血液中のヒトアルブミン(ALB)の最高濃度は約4,000 ng/mlでした。これらのマウスの生着効率では、応用するには不十分です。したがって、ヒトESC/iPSC-HLCを有するヒト肝臓キメラマウスにおけるキメラ率を向上させる必要があります。これにより、これらのマウスを医療応用において使用可能にするための基盤が初めて整うことになります。
一般的に、ヒトES細胞/iPS細胞由来のヒト肝細胞(HLC)の肝臓ヒト化マウスにおける生着効率は、免疫不全マウスの種類や肝損傷の程度、ドナー細胞の特性など、多くの要因に依存します。受容体マウスに関しては、免疫不全の重症度と肝損傷の程度が高いほど、マウス肝細胞を凍結保存したヒト肝細胞で置き換えることが容易になります。以前、上記要件を満たす肝臓ヒト化マウスを樹立するために、複数のマウスモデルが開発されました。すなわち、ウロキナーゼ型プラスミノーゲンアクチベーター転移遺伝子重症複合免疫不全(uPA:SCID)マウス、フマリルアセトアセテートヒドロラーゼと再構成活性化遺伝子2およびインターロイキン2受容体γ鎖欠損(Fah−/−:Rag2−/−:IL2rg−/−)マウス、およびヘルペス単純ウイルス1型チミジンキナーゼ転移遺伝子NOG(TK-NOG)マウスです。これらのマウスモデルのうち、uPA/SCIDマウスは、凍結保存されたヒト肝細胞の移植により、ほぼ完全にヒト化され、ヒトの肝機能を有する肝臓ヒト化マウスを樹立するために広く使用されています。ドナー細胞に関しては、凍結保存されたヒト肝細胞と同等の特性を持つと思われるヒトiPSC-HLCが、肝臓ヒト化マウスの作製に必要となる可能性があります。したがって、ヒトiPSC-HLCの肝成熟を促進することが重要です。私たちは最近、肝転写因子の過剰発現と3次元培養の組み合わせにより、高機能なヒトiPSC-HLCの作製に成功しました。ヒトiPSC-HLCsと一次ヒト肝細胞における各種肝細胞関連遺伝子の発現レベルは同等でした。これらの成熟したヒトiPSC-HLCsは、高生着率を有する肝臓ヒト化マウスを樹立するためのドナー細胞として適している可能性があります。
一方、移植された肝細胞の大部分が急速にアポトーシスによる死を遂げ、マクロファージによる貪食作用を通じて受容体肝臓から除去されることが知られています。したがって、抗アポトーシス遺伝子(例えばB細胞リンパ腫エクストララージ(Bcl-xL))の過剰発現により、細胞生存シグナルを調節し、アポトーシスによる細胞死に対する耐性を向上させることで、生着効率が向上する可能性が考えられます。正常な肝臓で合成されるBcl-2ファミリータンパク質のうち、Bcl-xLと骨髄性白血病1(Mcl-1)タンパク質のみが恒常的な基礎レベルで検出可能でした。さらに、再生肝ではBcl-xLの発現のみが上昇していました。また、肝細胞特異的Bcl-xL欠損マウスでは、肝細胞における自発的な細胞死が観察されました。一方、Bcl-xLトランスジェニックマウスでは、抗Fas抗体による細胞死に対して抵抗性を示しました。これらの報告は、Bcl-xLが肝細胞の生存に重要な役割を果たす可能性を示唆しています。
本研究では、まず、Bcl-xLよりも強力な人工的な抗アポトーシス因子であるFNK(Bcl-xLの過活性変異体)の過剰発現が、in vitro培養モデルにおいてアポトーシスの誘導を回避するのに有用かどうかを調べました。次に、3次元培養条件下で分化させたFNK発現アデノウイルス(Ad-FNK)ベクターで形質転換したヒトiPSC-HLCをuPA/SCIDマウスに移植し、肝臓ヒト化マウスを樹立することを試みました。これによりAd-FNKで処理したヒトiPSC-HLCは、マウス血液中のヒトALB濃度および生着効率を増加させることができるかどうか、つまりiPSC-HLCを用いたヒト肝臓キメラマウス作製に有用かどうかを解析しました。
2.方法論
ES細胞やiPS細胞の培養や樹立法、分化誘導法等は、似たような論文の紹介が続きますので、比較にも便利と思いますので概要を記載しておきます。
(1)ヒトiPS細胞の培養
ヒト男性胚性肺線維芽細胞株MCR5から作成されたヒトiPS細胞株は、JCRB細胞バンク(Dotcom、JCRB番号:JCRB1327、大阪府、日本)から提供されました。このヒトiPSC株は、ミトマイシンC処理マウス胚性線維芽細胞(PMEF-H;Merck Millipore、ビルリカ、マサチューセッツ州、米国)のフィーダー層上で、10 ng/mlの線維芽細胞増殖因子2(Sigma-Aldrich、セントルイス、ミズーリ州、米国)を添加したReproStem(ReproCELL、東京、日本)で維持しました。ヒトiPSCは、0.1 mg/mlのディスパース(Roche Diagnostics、バーゼル、スイス)で小さな塊に分散させ、その後、5日または6日ごとに継代培養しました。
(2)Adenovirus(AD)ベクター
Adベクターは、改良されたin vitroリガース法により構築しました。私たちは、以前の報告で、ヒト伸長因子-1a(EF-1a)プロモーターを含むpHMEF5とpAdHM41-K7を構築しています。FNK遺伝子(日本医科大学(東京、日本)の太田重雄氏からご提供いただいた)をpHMEF5に挿入し、pHMEF-FNKを得ました。pHMEF-FNKは、I-CeuI/PI-SceI(NEB、イプスウィッチ、マサチューセッツ州、米国)で消化し、I-CeuI/PI-SceIで消化されたpAdHM41-K7に連結し、pAd-FNKを作製しました。ヒトEF-1aプロモーター駆動型LacZ-, FOXA2-、またはHNF1a発現アデノウイルスベクター(それぞれAd-LacZ、Ad-FOXA2、またはAd-HNF1a)は、以前に構築しています。すべてのAdベクターは、ヒトiPS細胞および胚体内葉細胞への効率的な遺伝子導入を可能にするため、fiber knob領域のC末端部にリシン残基(K7)ペプチドの連続配列を含み、トランスフェクション効率はほぼ100%でした。ベクターは以前報告された方法に従って精製しました。ベクター粒子(VP)の力価は分光光度法を用いて測定しました。in vitro解析により、Adベクター媒介の遺伝子発現は5日間継続し、導入後9日目にほぼ消失することが確認されました(27)。したがって、uPA/SCIDマウスに移植されたヒトiPSC-HLCにおけるAdベクター媒介のFNK発現は、移植後約9日目に消失する可能性があります。
(3)in vitro分化
肝細胞分化プロトコルは、以前の報告(Takayama et al. Biomaterials 34:1781-1789; 2013)を基に作成しました。34日目に、ヒトiPS細胞由来の細胞に、FNKまたはLacZを発現するアデノウイルスベクター(Ad-FNKまたはAd-LacZ)を3,000 VP/細胞の濃度で感染させました。
(4)アポトーシス阻害活性
ヒトHLCは、アポトーシス阻害剤を含む肝細胞培養液 (HCM;Lonza、バーゼル、スイス)に、20 ng/mlのオンコスタチンM(R&D Systems)、10−6Mのデキサメタゾン(Sigma-Aldrich)、およびアポトーシス誘導薬(40 nMのスタウロスポリンまたは2 μMのA23187;いずれもMerck Millipore)を添加し、4日間培養しました。これらの細胞はセルリカバリーソリューション(BD Biosciences)を使用して回収し、生存細胞は毎日トリパンブルー(Nacalai Tesque、京都、日本)排斥法により計数しました。
(5)その他の方法
Flow Cytometry、Cell Viability Tests、Transplantation of the Hepatocyte-Like Cells、ELISA、RNA Isolation and Reverse Transcription-Polymerase Chain Reaction (RT-PCR)、Immunohistochemistry、Statistical Analysisについては省略します。
3.FNKは細胞死刺激に対する耐性を強化
ヒトiPSC-HLCを作製するために、FOXA2とHNF1aの時期特異的な一過性遺伝子導入(28)および3次元培養法(30)を用いて肝細胞分化を実施しました(図1)。
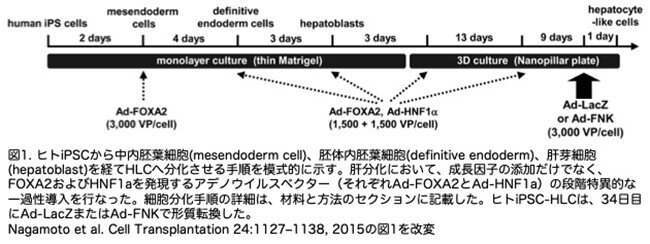
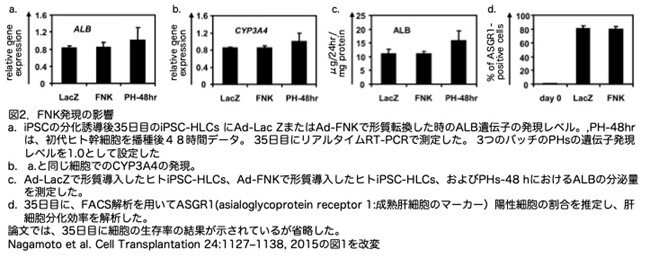
34日目に、ヒトiPSC-HLCsにAd-LacZまたはAd-FNKを導入し、その後、肝細胞関連マーカーの遺伝子発現レベル(図2a,b)、ALBの分泌能 (図2c)、およびASGR1(成熟肝細胞マーカー)陽性細胞の割合(図2d)を比較しました。その結果、Ad-FNKで形質転換されたヒトiPSC-HLCの肝細胞特性は、Ad-LacZで形質転換されたヒトiPSC-HLCの肝細胞特性と類似しており、FNKの一時的な過剰発現が肝細胞分化に影響を与えないことが示唆されました。さらに、ヒトiPSC-HLCにおけるALBとCYP3A4の遺伝子発現レベルは、細胞を播種後48時間培養した一次ヒト肝細胞(PH)と類似していました。これにより、効率的な肝分化が達成されたことが示唆されました。
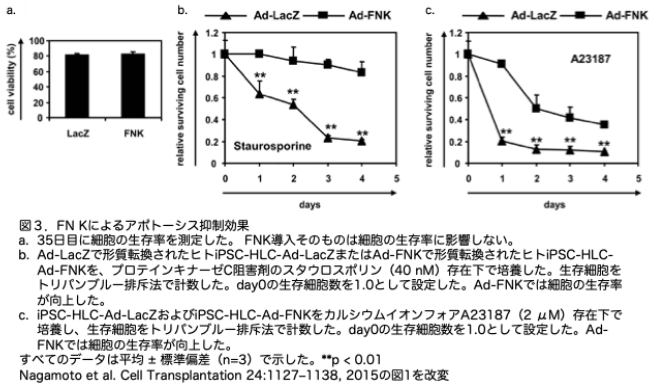
次に、FNKの過剰発現がアポトーシス刺激に対する耐性を高める能力を有するかどうかを調べました。アポトーシス誘導薬であるスタウロスポリン(プロテインキナーゼC阻害剤)とA23187(カルシウムイオンフォア)の存在下で、生存するヒトiPSC-HLCの数を測定しました。Ad-FNKの遺伝子導入そのものは細胞生存率に影響しませんでしたが(図3a)、スタウロスポリンおよびA23187の存在下で、Ad-FNKを導入したヒトiPSC-HLCの生存細胞数は、Ad-LacZを導入したヒトiPSC-HLCの生存細胞数よりも高くなりました(図3b, c)。これらの結果は、ヒトiPSC-HLCにおけるFNKの過剰発現が、肝臓マーカーの発現に影響を与えることなく、アポトーシス刺激に対する耐性を高める可能性を示唆しています。
4.ヒト血中ALB濃度は、iPSC-HLC-Ad-FNKの移植により増加
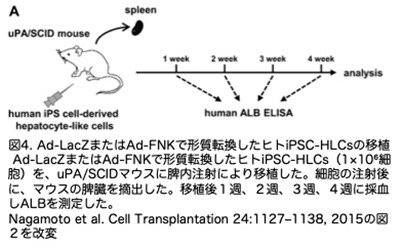
免疫不全マウス(肝臓損傷モデル)におけるヒトiPSC-HLCsの生着と再構築効率を、Ad-FNK導入によって向上させられるかどうかを検証するため、ヒトiPSC-HLCs-Ad-LacZまたはヒトiPSC-HLCs-Ad-FNKを、脾内注射によりuPA/SCIDマウスに移植しました(それぞれLacZマウスとFNKマウスと略称します)。脾内注射された肝細胞の一部がレシピエントマウスの脾臓に生着することが報告されているため(Sharma et al. Toxicol. Pathol. 40:83-92; 2012)、ヒトiPSC-HLCの移植直後に受容体の脾臓を摘出することで、受容体の脾臓に生着したヒトiPSC-HLCの影響を排除しました。細胞移植の実験計画を図4に示します。
マウス血液中のヒトALB濃度は、凍結保存されたヒト肝細胞を移植したマウスにおける生着したヒト肝細胞の数と相関することが知られているため、LacZマウスとFNKマウスの血液中のヒトALB濃度をモニタリングしました(図5a)。LacZマウスとFNKマウスの血液中のヒトALBは、移植後1週間で検出可能でした。FNKマウスのヒトALB濃度(約73 ng/ml)は、LacZマウス(約30 ng/ml)よりもやや高くなりました。その後、これら2群におけるヒトALB濃度は移植後4週間まで増加し続け、LacZマウスでは約7,400 ng/ml、FNKマウスでは約24,000 ng/mlに達しました。FNKマウスにおける血液中のヒトALB濃度は、移植後2~4週時点でLacZマウスよりも有意に高いことが分かりました。残念ながら、LacZマウスとFNKマウスは移植後4週時点で衰弱したためこの時点で安楽死させました。安楽死時、明確な腫瘍は観察されませんでした。LacZマウスまたはFNKマウス内のヒトiPSC-HLCにおける肝細胞特異的マーカーの遺伝子発現レベルは、ヒト特異的プライマーを使用して測定しました。まず、ヒトiPSC-HLCにおけるヒトALBの発現レベルをリアルタイムRT-PCRで解析しました(図5b)。両群間に有意な差は認められなかったため、FNKマウスにおけるヒトiPSC-HLCのヒトALB分泌能は、LacZマウスにおけるヒトiPSC-HLCのそれと同様であると考えられます。したがって、LacZマウスとFNKマウスにおけるヒトALB濃度の差は、ヒトiPSC-HLCの生着効率によるもので、LacZマウス とFNKマウスにおけるヒトiPSC-HLCのヒトALB分泌能の差によるものではないと考えられます。
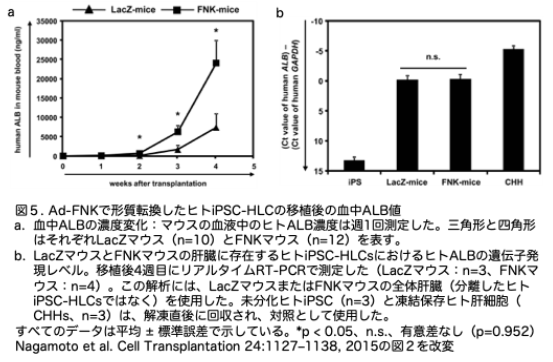
これらの結果を総合すると、FNKマウスにおける再増殖したヒトiPSC-HLCsの数は、LacZマウスよりも高いことが示唆されました。
5.iPSC-HLCでの肝細胞関連遺伝子発現は、移植後に上昇
ヒトiPSC-HLCの肝機能がuPA/SCIDマウスへの移植により促進されるかどうかを調べるため、FNKマウス肝臓に移植されたヒトiPSC-HLCにおけるヒト肝細胞関連マーカーの遺伝子発現レベルを、移植後4週間(移植後)の値と、移植されていないヒトiPSC-HLCの遺伝子発現レベルを比較しました (移植前)(図6)。
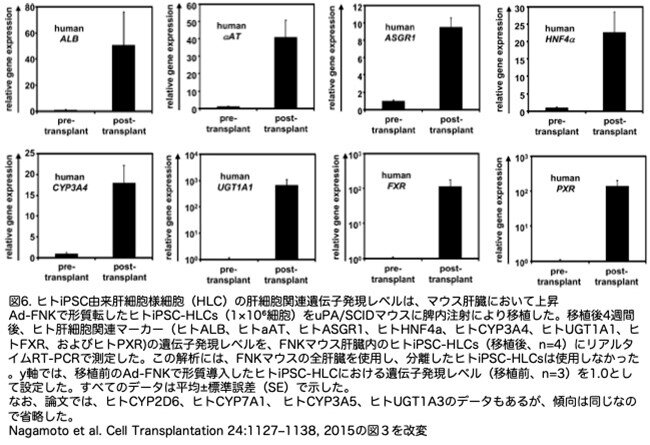
興味深いことに、ヒトALB、ヒトaAT、ヒトASGR1、ヒトHNF4a、ヒトCYP3A4、ヒトCYP2D6、ヒトCYP7A1、ヒトCYP3A5、ヒトUGT1A1、ヒトUGT1A3、ヒトFXR、およびヒトPXRの遺伝子発現レベルは、移植後に著しく上昇しました。なお論文では、ヒトCYP2D6、ヒトCYP7A1、 ヒトCYP3A5、ヒトUGT1A3のデータも示されていますが、傾向は同じなので省略します。これらの結果は、ヒトiPSC-HLCがuPA/SCIDマウス肝臓内で成熟した可能性を示唆しています。
6.FNKによるiPSC-HLCsのマウス肝臓における生着率の向上
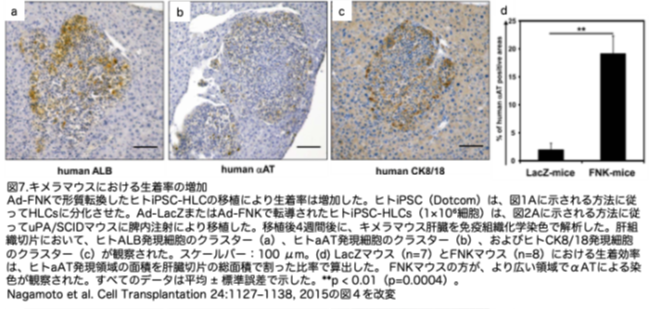
マウス肝臓でのヒトiPSC-HLCsの生着を確認するため、肝細胞特異的マーカーと反応するヒト特異的抗体を用いた免疫組織化学的解析を行いました。FNKマウス肝臓の切片において、ヒトALB陽性(図7a)、ヒトaAT陽性(図7b)、およびヒトCK8/18発現細胞のクラスター(図7c)が複数確認されました。ヒト肝細胞特異的マーカー陽性のクラスターは、LacZマウスにおいても観察されました(データなし)。これらの結果は、ヒトiPSC-HLCがマウス肝臓においてヒト肝臓タンパク質を再構築し発現していることを示唆しています。ヒトALB抗体の非特異的染色が一部観察されたため、LacZまたはFNKマウスにおけるヒトiPSC-HLCの生着効率を、ヒトaAT発現領域の面積を肝臓切片の総面積で割った比率を推定することで算出しました(図7d)。ヒトiPSC-HLC-Ad-FNKの生着効率は、ヒトiPSC-HLC-Ad-LacZよりも有意に高くなりました。これらの結果を総合すると、ヒトiPSC-HLCでのAd-FNKの発現は、マウス肝臓を効率的に生着させる有用なツールとなることが示されました。
7.要約と問題点
本研究の目的は、医療応用を目的としたマウス肝臓におけるヒトiPSC由来肝細胞(iPSC-HLCs)の生着効率を向上させることでした。ヒト肝臓のキメラ率が高いキメラマウスを樹立するため、抗アポトーシス遺伝子(FNK)を形質導入したヒトiPSC-HLCsをuPA/SCIDマウスに移植しました。FNKマウスにおけるヒトALBのレベルと生着効率は、LacZマウスよりも高いことが分かりました。肝細胞移植における脾内投与では、移植された細胞の主要な割合(70%以上)が、食細胞とマクロファージの反応により迅速に除去されます。残存した移植肝細胞は、移植後16~20時間で肝小葉から肝板(liver plate)へ移動しました。この期間中、移植肝細胞は細胞外マトリックスや他の細胞との密接な接触を失うため、カスパーゼ8の活性化によりanoikisアノイキス(接着細胞が足場から離れ浮遊状態になると,増殖因子や栄養因子の存在下でもアポトーシスが誘導される現象で,anoikisはギリシャ語で「宿なし」を意味し、遊離細胞が異所性に増殖するのを防ぐ機構と考えられています)を引き起こす可能性があります。Bcl-xLの異所性発現は、カスパーゼ8、7、3の抑制によりアポトーシスを阻害することが知られています。これらの事実から、移植されたヒトiPSC-HLCは、移植直後の早期段階でFNKの過剰発現によりアポトーシスから保護され、その後、受容体マウスの肝臓の肝小葉から肝板へ移動する可能性が示唆されます。
Bcl-xLは細胞性発がん遺伝子として知られていますが、移植後4週間のFNKマウスにおいて特異的な腫瘍は観察されませんでした。この結果は、アデノウイルスベクターを用いたFNKの一時的な形質導入が、移植されたヒトiPSC-HLCの腫瘍形成に関与していない可能性を示唆しています。この考えと一致して、以前の研究では、アデノウイルスベクターによるFNKの過剰発現が、軟寒天コロニー形成アッセイにおいて樹状細胞を変異させないことが示されています。これらの結果を総合すると、FNKの過剰発現は、移植細胞の生着効率を向上させる有用な方法となる可能性があります。
FNKマウス血液中のヒトALB濃度は、LacZマウス血液中の濃度よりも有意に高いことが分かりました。さらに、FNKマウス血液中の濃度(約24,000 ng/ml)は、以前の研究におけるマウス血液中の濃度(約4,000 ng/ml)の約6倍高いです(コラム第16話で紹介した論文です:Woo et al. Gastroenterology 142(3):602-611; 2012)。しかし、生着率が約19%であったFNKマウスの血液中のヒトALB濃度は、凍結保存されたヒト肝細胞をuPA/SCIDマウスに移植して作製された肝臓ヒト化マウス(再殖効率約20%)の血液中の濃度(約1 mg/ml)(コラム第8話で紹介した論文です:Tateno et al. Amer. J. Pathol 165:901-912, 2004)と比べて、約42倍低いものでした。これらの2つの群の生着効率が類似していたことから、FNKマウスの血液中へのヒトALB分泌能力が低いのは、凍結保存ヒト肝細胞と比較して、ヒトiPSC-HLCの肝機能の未熟さが原因である可能性が示唆されました。実際、凍結保存されたヒト肝細胞は、ヒトiPSC-HLCsに比べてヒトALBを約50倍高いレベルで発現していました(図5b)。ヒトiPSC-HLCsのヒトALB遺伝子発現レベルは移植後に上昇しましたが、それでも凍結保存されたヒト肝細胞との差は顕著でした。ヒトiPSC-HLCにおけるヒトALBの遺伝子発現レベルが長期的に上昇する可能性はあるものの、本研究では移植後4週間でLacZマウスとFNKマウスともに衰弱しました。これらの結果は、移植されたヒトiPSC-HLCがレシピエントマウスの肝機能を維持できなかったことを示唆しており、これはヒトiPSC-HLCの肝機能が凍結保存されたヒト肝細胞よりも低かったからです。したがって、完全に機能するヒト型肝臓を有するヒト肝臓キメラマウスを作製するためには、成熟したiPSC-HLCを誘導するための技術的改善がさらに必要です。なお、本研究では移植後4週目でマウスを安楽死させました。しかし、これらのマウスを4週間を超えて観察することは興味深いでしょう。上記の議論をわかりやすくするため表1に3つの論文の結果をまとめています。

興味深いことに、FNKマウス由来の肝細胞様細胞(HLC)において、移植前のiPSC-HLC-Ad-FNKと移植後のiPSC-HLC-Ad-FNKを比較して、ヒト肝細胞関連遺伝子の発現レベルに有意な増加が観察されました(図6)。この結果は、生体内の肝臓環境の特性、例えば他の細胞との相互作用、機能的極性、および細胞外マトリックスなどによるものと考えられます。今後の研究では、移植されたマウス肝臓からヒトiPSC-HLCを分離し、in vitroでの薬物毒性スクリーニングに用いることが興味深いと思われます。過去の研究では、ヒト多能性幹細胞由来の膵細胞がマウスへの移植後少なくとも3ヶ月で成熟し、機能的なβ細胞に分化することが示されています。したがって、ヒトiPSC-HLCsは移植後により長い期間(4週間以上)でさらに成熟する可能性があります。マウス肝臓に再生着したヒト肝細胞は、他のマウスの肝臓に連続移植され生存することが示されており、連続移植されたマウスの再生着効率は、最初に移植されたマウスよりも高いものでした(第9話で紹介した論文です:Azuma et al. Nat. Biotechnol. 25(8):903-910; 2007。また、同じことは第13話でも紹介しました:Michailidis et al. Proc Natl Acad Sci USA. 117:1678-1688, 2020)。したがって、ヒトiPSC-HLCの連続移植は再殖民化効率を向上させることができます。
次はコラム第18話です
コラム第14話と第15話、第17話ではiPS細胞を分化誘導して得た肝細胞様細胞を用いて、第16話はヒトES細胞由来の肝細胞様細胞を用いて肝臓ヒト化マウスを作製に関する話題でした。ただ、表1に示しましたが、細胞レベルではmRNAレベルの発現レベルは同じであったり免疫組織染色でも十分染色され一見良さそうですが、血中ALB濃度という成体レベルで肝臓としてのその機能を調べると、いずれもPHHの結果よりはずっと悪い(24μg/mL対7800μg/mLで0.3%)ものでした。次回の第18話は、多能性幹細胞を介さず、体細胞(線維芽細胞)からのリプログラミングにより直接誘導した肝細胞を利用した論文で、「Du et al. Human Hepatocytes with Drug Metabolic Function Induced from Fibroblasts by Lineage Reprogramming. Cell Stem Cell 14: 394-403, 2014」を紹介します。