肝臓ヒト化マウスの歴史 第19話
肝前駆細胞由来の肝細胞を用いた肝臓ヒト化マウスの作製
これまで肝臓ヒト化マウスを作製するため用いられてきた4つの細胞について紹介しました。
その4つとは、(1)ヒト肝臓から直接得られた「一次性ヒト肝細胞Pirmary human hepatocyte (PHH)」(コラム第4話から第12話)、(2)PHHを免疫不全マウスに移植したあとその肝臓からヒト肝細胞を回収して得たのが「マウス継代一次ヒト肝細胞(mouse-passaged primary human hepatocytes:mpPHH)」(コラム第13話)、(3)多能性幹細胞から分化誘導したのが「hepatocyte-like cell (HLC)」(コラム第14話、15話、16話、17話)、(4)線維芽細胞から誘導したのが「human induced hepatocyte(HIP)」(コラム18話)です。そして今回の肝前駆細胞から得られたのが「proliferating human hepatocyte (proliHH)」で、「Zhang et al. In vitro expansion of primary human hepatocytes with efficient liver repopulation capacity. Cell Stem Cell 23: 806-819, 2018」の論文を紹介します。各名称は、研究者が勝手に命名したもので、あまり統一感はなく混乱しそうですが、かといって統一的な名前を命名するのは現時点ではできそうもありません。そこは我慢してお読みください。
なお、略称が多く混乱しないように、細胞の略称は赤字で、培養液の略称は緑字で、そして、原著論文を読んだ方が混乱しないように、コラムの図が原著論文のどの図と対応しているのかは青字で、例えば、「図1a,b:原著論文Fig.S1A,S1B」にように示しました。
1.研究目的
肝臓の大きな特徴の一つは、損傷後の優れた再生能力です。肝臓が再生能力を失う末期の肝疾患において、唯一の治療法は肝移植です。しかし、臓器不足のため、肝移植の実際の使用は制限されています。PHHの移植は、臓器移植の代替手段として、臨床や動物モデルで評価されてきています。効率的な肝再生能力を持つヒト肝細胞(human hepatocyte: HH)は、肝疾患治療において大きな需要があります。しかし、肝細胞移植の実際の使用は、ドナー肝細胞の限られた供給能とPHHをin vitroで増殖させることができないため、目処が立っていません。
数十年にわたり、HHは増殖可能ではなく、研究目的や臨床での治療への応用のボトルネックとなっています。ヒト多能性幹細胞からのin vitro分化や、ヒト体細胞からの直接的な転換によって、HLCが樹立されています。この方法により、移植後にマウスの肝不全を救うことができる機能的なHLCを大量に産生することができました。しかしながら、ヒトHLCはマウスの肝臓での生着能力が限られています。HLCの再生効率は約2%であり、PHHの約70%に比べてはるかに低い値です。治療効果を得るためには、少なくとも約10%の肝細胞を置き換える必要があるため(Dhawan et al. Human hepatocyte transplantation: current experience and future challenges. Nat. Rev. Gastroenterol. Hepatol. 7, 288-298, 2010)、さらなる最適化が必要です。
肝再生のメカニズムを明らかにし、これらの発見をHH培養の改善に生かすための努力がなされてきました。酸素化されたまたはマイクロファブリケーションされた共培養(マイクロメートルµmサイズの微細加工技術を用いて、流路を作成し、液体の流れを制御する装置を利用し、培養ディッシュの各wellを細胞外基質でコートし、その上で肝細胞を培養する技術です)により、HHが数週間に渡り代謝機能を保持できますが、これらの細胞は増殖能力を失います。別の研究では、ハイスループットスクリーニングを使用して、HHを約10倍拡張する小分子が特定されました。さらに、胆管由来の二つの細胞系列に分化できる細胞から生成されたヒト肝オルガノイドは、長期にわたってin vitroで拡張可能です。しかし、増殖可能なオルガノイドからの細胞は、移植した場合はパフォーマンスが悪いようです。他の研究では、hTERTやSV40、E6、E7などのウイルス遺伝子を用いた不死化によってHHを拡張する努力がなされましたが、得られた細胞を用いたin vivo再生着は示されておらず、hTERTおよびウイルス癌遺伝子の過剰発現は、移植後の腫瘍形成のリスクを伴います。
細胞可塑性は最近、肝臓再生において重要な役割を果たすと認識されています。具体的には、損傷中に、マウス肝細胞は増殖性胆管様前駆細胞(proliferative biliary-like progenitor cells: HepPDs)に再プログラムさせることができます。これらの細胞は肝細胞の特徴を失いますが、肝臓前駆細胞の特性を示します。肝細胞からHepPDへの変換は、肝細胞マーカーと前駆細胞関連マーカーの共発現によって特徴付けられる二表現型の「中間」状態を通じて行われる可能性があります。最近の2つの研究では、それぞれ、実験室内での齧歯類肝細胞からの拡張可能な前駆細胞様細胞と管様細胞(duct-like cell)の生成が示されています。肝細胞遺伝子の発現がin vitroでは停止しているにもかかわらず、これらの細胞はマウスの肝臓の広範囲に再生着し、成熟肝細胞の特徴を取り戻せることが示されており、これは大規模に移植可能な肝細胞を生産する手段たり得ます。特に、慢性肝疾患において、前駆細胞関連マーカーを発現するHHが再生結節に存在することが記載されており、これは実験室内で「中間」状態のHH拡張するための適切な戦略である可能性を示しています。
本論文では、HHの増殖を促進する組成が明らかな培地を開発しました。低酸素培養と組み合わせることで、HHは1か月以上にわたり増殖し、10,000倍に増殖させることができます。このProliHHは二表現型細胞として特定され、成熟肝細胞のいくつかの特徴を保持し、前駆細胞関連マーカーを発現しています。これらの細胞は、肝臓の特徴を持たない前駆細胞様細胞である増殖中の齧歯類肝細胞とは異なり、ProliHHは成熟肝細胞に似た状態に戻ることができます。重要なことに、これらの細胞はFah欠損マウスの肝臓で強力に再生着しました。これらの発見は、ヒト由来の肝細胞由来の二表現型細胞が再生着の強力な能力を持つ高い増殖性細胞であることを示しています。
2.方法論
(1)ヒト肝細胞培養
Celsis In Vitro Technologies(米国メリーランド州ボルチモア)より提供された12名の凍結保存ヒト肝細胞を用ました。これらのドナー情報は表1に記載しています。細胞培養中に性差による偏りは認められませんでした。培地スクリーニング、肝細胞増殖および成熟に使用した培地のうちhuman liver isolation medium (HLIM)の組成を表2に示しました。
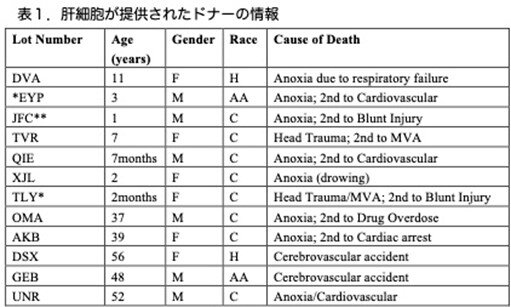
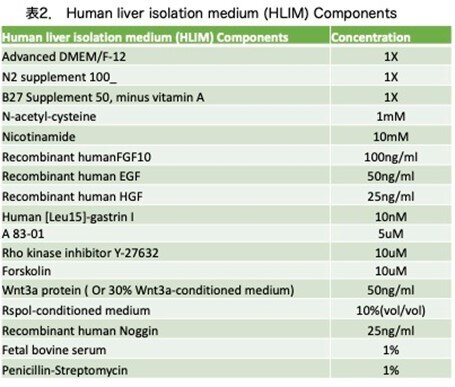
その他は、原著論文の表S3に記載されていますがここでは省略します。凍結保存されたPHHは、10%胎児牛血清(Sigma-Aldrich)添加DMEMで培養し、コラーゲンIでコーティングした培養皿に2×10⁴細胞/cm²で播種し、その後、細胞を37℃、常酸素状態(20% O₂、5%CO₂インキュベーター)または低酸素状態(5%O₂、5%CO₂インキュベーター)で培養しました。培地は播種10時間後にHMに交換し、その後は2日ごとに交換しました。初代培養6日目に細胞をトリプシン処理し、コラーゲンIコーティング済みディッシュに3×10⁴細胞/cm²で播種しました。培地は2日ごとに交換し、肝成熟のため、ProliHHsをHIM培地中で96ウェルプレート(クラレ株式会社)に8×10⁴細胞/ウェルで播種し、10日間培養しました。
(2)L-Wnt3a細胞培養
L-Wnt3a細胞はハンス・クレバース博士より提供され、10% FBSおよびゼコシン(125μg/ml)添加DMEMで培養し、細胞がコンフルエントに達した時点で、培地を10% FBS添加アドバンストDMEM/F-12に交換しました。2日間の培養後、上清をWnt3a条件培養液(conditioned medium)として回収し、Wnt3a条件培養液30%およびWnt3aタンパク質(50ng/ml)の活性はTOP/FOPアッセイにより測定しました。適切な活性はTOP/FOP値>25です。
(3)マウス
Fah-/-Rag2-/-Il2rg-/-(FRG)マウスはXing Wang博士より入手しました。FRGマウスはC57BL/6Jと129S6/SvEvTacの交雑系統であり、飲用水に7.5mg/L(または7.5μg/mlと表記されます)のNTBC(中国Capot Chemical社合成)を添加して飼育しました。移植には8~12週齢の雄雌混合マウスを使用し、性差による影響は認められませんでした。NOD/SCIDマウスを上海林昌生物技術より入手し、NOD/SCIDマウスはNOD系統を背景としており、移植には6~8週齢の雄マウスを使用しました。本研究で使用した動物はいずれも、事前に処置を受けたことがなく、薬剤および試験未経験です。全ての動物は、温度および光(12時間明暗サイクル)が制御された特定病原体フリー(SPF)動物施設で、常に仲間マウスと共にある個別換気ケージに収容しています。全ての動物実験は、上海生化・細胞生物学研究所の機関動物実験委員会によって承認されたプロトコルに従って実施しました。
(4)老化関連β-ガラクトシダーゼ分析
老化関連β-ガラクトシダーゼ(SA-β-gal)染色のため、細胞を4%パラホルムアルデヒドで室温5分間固定しました。製造元の指示に従い、Senescence Associated β-galactosidase Staining(Beyotime)を用いて染色しました。
(5)CYP代謝アッセイ
CYP2B6代謝活性の測定のため、ProliHHsをHIM培地中で96ウェルプレート(クラレ株式会社)に10日間培養し、陽性対照として、新鮮に解凍したヒト初代肝細胞を直接使用しました。細胞を基質を含む200μLの培養液中で37℃で3時間インキュベートし、反応停止のため、800μlの冷メタノールを添加し遠心分離しました。CYP2D6代謝活性の測定には、DEB(2mg/kg、Sigma)投与後0、0.5、1、2時間の時点で対照FRGマウスおよびProlHH-FRGマウスから血清(50μl)を採取しました。上清を回収し、LC-MS/MS(Agilent 1200 HPLCおよびABI 4000質量分析計)による代謝産物の測定を行いました。標準曲線作成に用いた基質および代謝産物は市販品を使用しました。
(6)Fah-/-:Rag2-/-:Il2rg-/-マウスへの細胞移植
細胞移植の6日前、FRGマウス用飲用水中のNTBC濃度をまず3日間3.75 mg/Lに減量し、その後さらに3日間完全に除去しました。初期継代(P4以前)および後期継代(P6以降)のProliHHs 5×10⁵個とPHHをPBS 100mLに懸濁し、FRGマウスに脾臓内移植し、移植後、マウスが体重の20%を失った時点で3日間一時的にNTBCを投与しました。4~5か月後にマウスを屠殺しました。
(7)その他の方法
低細胞密度におけるタイムラプスイメージング、組織学、免疫組織化学および免疫蛍光染色、PAS染色およびオイルレッドO染色のアッセイ、RNAシーケンスデータ処理、経路エンリッチメント解析、統計解析については省略します。
3.ProliHHを誘導する培養システムの確立
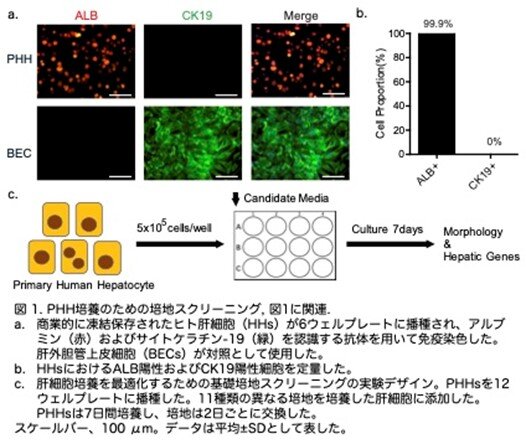
著者らは、まず肝細胞培養を最適化するための基本的な培地を特定し、その後肝細胞の増殖のためにこの培地を修正しています。以前の研究および商業ソースに基づき、合計10種類の異なる培地を実験に使用しました。99.9% ALB陽性および100% CK19陰性の凍結保存されたヒト肝細胞(図1a,b:原著論文Fig.S1A,S1B)は、80%の密度で播種し、組成の異なる培地の維持効果を評価するため、7日間培養後のHHの形態と遺伝子発現レベルを解析しました(図1c:原著論文Fig.S1C)。
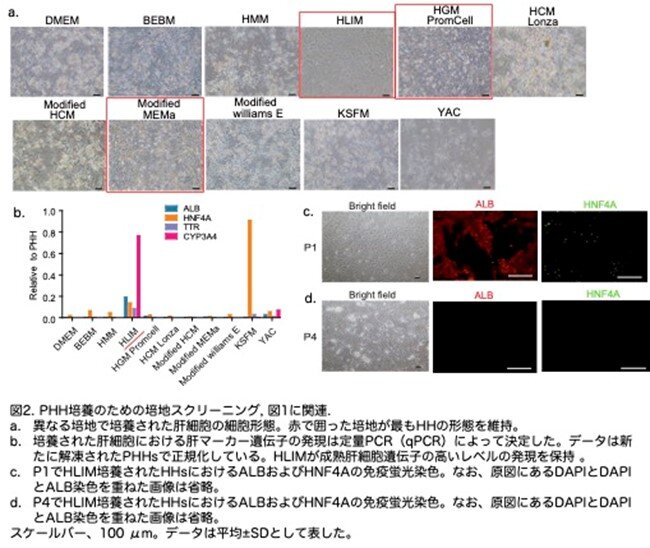
10種類の培地の中で、ヒト肝臓分離培地(human liver isolation medium: HLIM)、肝細胞増殖培地(hepatocyte growth medium: HGM)、および改変最小Eagles'培地a(modified minimum Eagles' medium a: MEMa)は、HHの形態を最もよく維持することができました(図2a:原著論文Fig.S1D)。
ここで余談ですが、細胞培養液のことを説明しておきたいと思います。この論文はただでさえ長く、図表が非常に多いので、読み切るのが大変で、その上培養液のことまで読まされるのは大変だと思う方はスキップしてください。培養液の組成は原著論文の補足表3にありますが、上記の3つの培養液のうち、HLIMだけは明快に記述がありそれは表2に示しました。しかし、HGMについてはPromoCell社製とありましたが、ネット検索するとすでに販売中止になっており情報は得られませんでした。MEMaについては該当するものの記載はなく、関連するDMEMは記載されていました。DMEMだけでは分からない人もおられると思いますので、少し遡って簡単に説明しておきます。
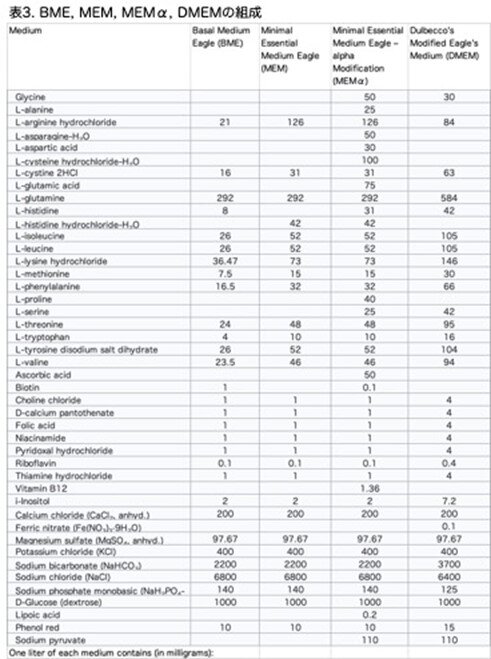
(1)Minimum Essential Meidum(MEM)は、Harry Eagleによって開発され、1959年に『Science』誌で初めて発表された合成細胞培養培地で、組織培養において細胞を維持するために使用しています。これは1943年にEarle塩で記述された6種の塩類とグルコースを基としています:塩化カルシウム、塩化カリウム、硫酸マグネシウム、塩化ナトリウム、リン酸ナトリウム、炭酸水素ナトリウム。この培地にはさらに13種類の必須アミノ酸と8種類のビタミンが添加されています:チアミン(ビタミンB1)、リボフラビン(ビタミンB2)、ニコチンアミド(ビタミンB3)、パントテン酸(ビタミンB5)、ピリドキシン(ビタミンB6)、葉酸(ビタミンB9)、コリン、ミオイノシトール(当初はビタミンB8として知られていた)。この培地には多くの改変が加えられており、主に追加のビタミン、アミノ酸、および/またはその他の栄養素が添加されています。
(2)Eagleは1955年から1957年にかけて、マウスL細胞およびヒトHeLa細胞を用いて、13種類の必須アミノ酸と9種類のビタミンを添加した初期の「Basal Medium Eagle(BME)」を開発しました。BMEにはビオチン(ビタミンB7)が含まれていましたが、Eagleは後にこれが不要であることに気づきました。1959年に発表した「Minimal Essential Medium(MEM)」では、多くのアミノ酸の量を2倍にし、「培養ヒト細胞のタンパク質組成により厳密に適合させる」ことで、「再投与なしで培養を多少長く維持できるようにした」ようです。
(3)DMEM(Dulbbecco's modified Eagle's medium)は、Renato DulbeccoとG. Freemanが1959年に発表した「アミノ酸とビタミンの濃度を4倍にした「Eagle's medium」として提案されました。市販版には追加改良が施されており、表に例を示します。
(4)α-MEM(Minimal essential medium Eagle-alpha modification)は、論文で記載されているMEMaと思われますが、1971年にClifford P. Stannersらが発表したMEMを基にした培地です。MEMと比較して、非必須アミノ酸、ピルビン酸ナトリウム、ビタミン(アスコルビン酸(ビタミンC)、ビオチン、シアノコバラミン)をより多く含んでいます。リポ酸やヌクレオシドを含む場合もあります。
上記の培養液の組成を表3に示しました。これを見るといかに多くの成分が使われているかがわかると思います。今では想像できないと思いますが、細胞培養が始まった頃は、研究者自身がこれらの成分を天秤で測り調整していました。今では購入できるので、現在の研究者はいかに労力と時間を節約できるかが分かると思います。その代わり、多額の研究費が必要です。
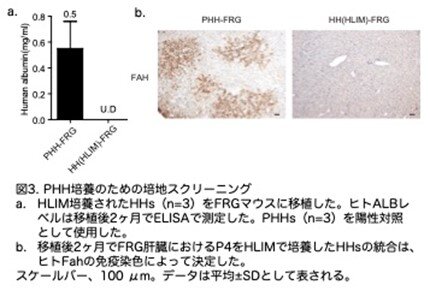
元に戻りますが、HLIMは、解凍したヒト肝細胞と比較して、ALB、TTR、CYP3A4などの成熟肝細胞遺伝子の高いレベルの発現を保持していました(図2b:原著論文Fig.S1E)。またHLIMは、最初のパッセージでHHの増殖を誘導しました。対照的に、Y-27632、A-83-01、およびCHIR99021(YAC)培地を含むマウス肝細胞培地は、マウス肝細胞の増殖を誘導することが報告されていますが、HHの増殖には効果がありませんでした。しかし、HLIMで培養された細胞は、ALBおよびHNF4Aの発現が減少し、形態的変化が起こり、パッセージ後に成熟肝細胞の特徴をすぐに失いました(図2c,d:原著論文Fig.S1F,S1G)。HLIMで培養した細胞をFah欠損マウスに移植すると、肝臓に生着する能力が低いことが示されました(図3a,b:原著論文Fig.S1H,S1I)。
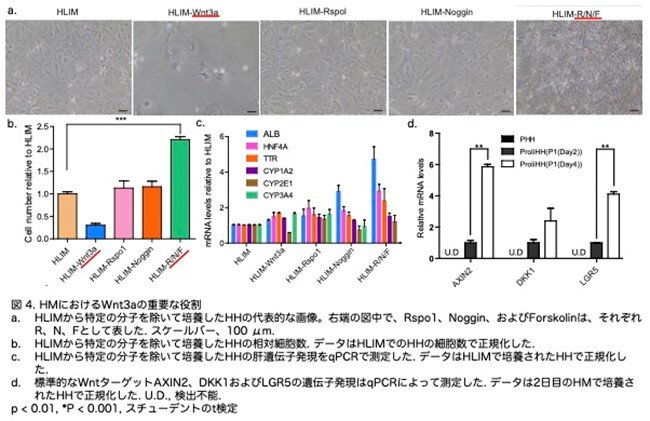
上記の結果から、著者らはHLIMを調整することにしましたが、HLIMの中の重要な成分、例えばWnt3a、Rspo1、Noggin、およびフォルスコリンがHHの培養に最適化されていない可能性があると推測しました。特に、Wnt3aが含まれているconditioned mediumを除去すると、HHの増殖が劇的に減少しました(図4a,b:原著論文Fig. S2A,S2B)。Rsotipo1 または Noggin の除去は肝細胞の増殖に影響を与えませんでしたが(図4b:原著論文Fig.S2A)、ALB 発現を増加させました(図4c:原著論文Fig.S2C)。Rspo1、Noggin、およびフォルスコリンを HLIM から除去した新しい培地は 、HH の増殖(図4b:原著論文Fig.S2B)と肝遺伝子発現を著しく改善しました(図4c:原著論文Fig.S2C)。これらの発見は、Wnt3a が重要であることを示しています。実際、Wnt 経路のAXIN2、DKK1およびLGR5はかなりの程度で活性化されていました(図 4d:原著論文Fig.S2D)。
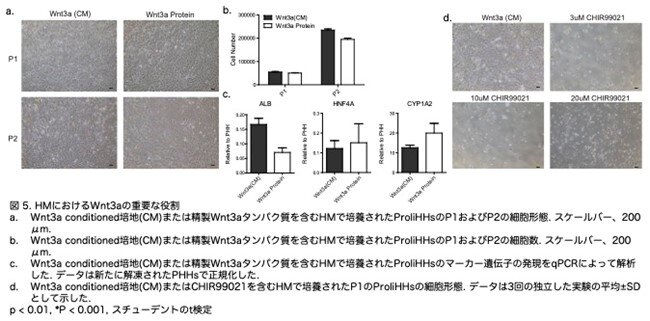
精製された組換えWnt3aタンパク質は、HH の増殖と肝遺伝子発現の維持のために Wnt3a conditioned mediumを効率的に置き換えることができました(図5a-c:原著論文Fig.S2E-S2G)。しかし、GSK3bの高選択的阻害剤である CHIR99021 は HHの増殖を促進しませんでした(図5d:原著論文Fig.S2H)。Rspo1、Noggin、およびフォルスコリンを除去した HLIM を HHの増殖のためのヒト肝細胞培地(HM)として定義しました。
4.ProliHHsは肝細胞の特徴を部分的に維持する
HM で培養した後、PHHs は 2 日目に増殖を開始しました(図6a,b:原著論文Fig.1A,1B)。著者らは、77.8% ± 4.1% の細胞が Ki67 陽性であり、3 時間のブロモデオキシウリジン(BrdU)パルスラベリングで、3 日目に 21.8% ± 4.8% の細胞が S期にあったことを見出しました(図6c:原著論文Fig.1C)。
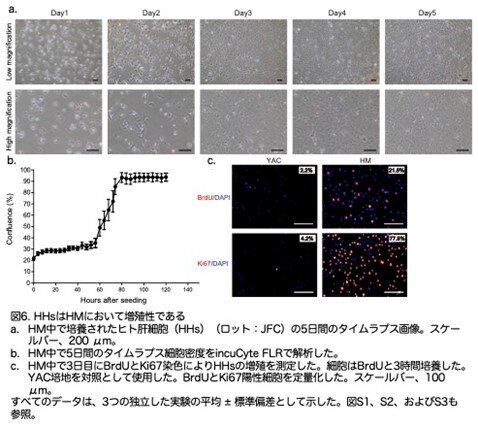
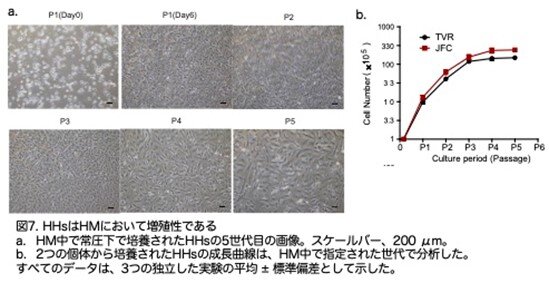
特に、HM で培養した2人の個体からのHHは、ほぼ 1ヶ月間連続的にパッセージでき、300 倍に増加しました(図7a,b:原著論文Fig.1D,1E)。HM で培養されたHHは4回のパッセージ後に増殖を停止しました(図7b:原著論文Fig.1E)。
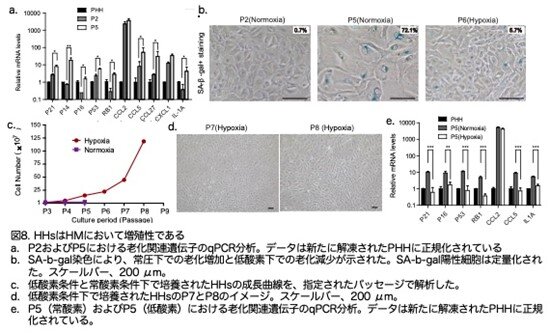
著者らは、興味あることに細胞周期停止遺伝子および老化遺伝子の発現レベルが培養中に著しく増加したことを見出しました(図8a:原著論文Fig.S3A)。SA-β-gal 染色は老化が起きていることを示しており、これが HH の増殖 停止の理由であるかもしれません(図8b:原著論文Fig.1F)。低酸素状態が培養細胞の老化を防ぐことが報告されているため、筆者らはHHをHM培地で5% O2 の低酸素条件で培養しました。低酸素培養は HH の増殖を4 回のパッセージを追加して延長することができました(図8c,d:原著論文Fig.1G および1H)。低酸素条件下で培養されたHHは、細胞周期停止遺伝子および老化遺伝子の発現が減少し、SA-β-gal 陽性細胞の数が減少しました(図8e:原著論文Fig.S3B)。低酸素条件下のHHは、総数で約10,000 倍の増加を示しました(図 8c:原著論文Fig.1G)。
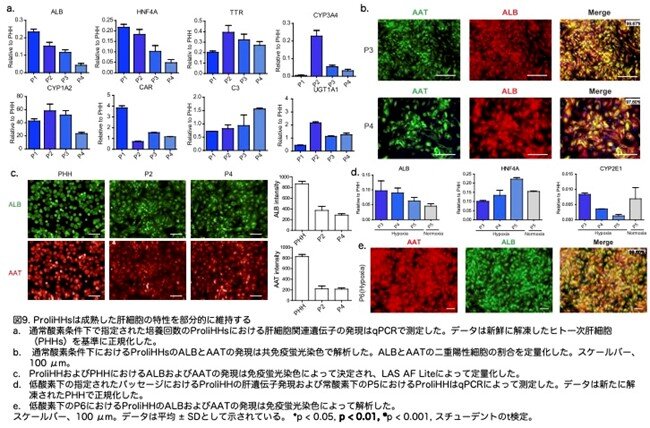
次に、HM培養 ProliHH の肝遺伝子発現および肝機能を常酸素状態で評価しました。成熟肝細胞遺伝子は ProliHH で発現はしていましたが、解凍したばかりの PHHとは異なるレベルでした。すなわち、ALB、HNF4A、TTR、および CYP3A4 は低いレベルで発現し、CYP1A2、CAR、C3、および UGT1A1 は同様のレベルまたはそれ以上でした(図9a:原著論文Fig.2A)。ALB および AAT タンパク質の発現は免疫蛍光染色によって検証し、パッセージ 3(P3)および P4 で 97% 以上のProliHHが ALB および AAT の両方に陽性であることが示されました(図9b,c:原著論文Fig.2B,S3C)。これらのデータは、肝細胞遺伝子の発現がほとんど検出できなかった増殖可能な齧歯類肝細胞とは異なっていました。注目すべきは、ProliHH が正常酸素および低酸素下で肝遺伝子の発現に差があったことです(図9d,e:原著論文Fig.S3D,S3E)。興味深いことにHHは増殖中に四倍体を失い、二倍体に移行し、解凍したばかりの PHHでは四倍体が 67%、二倍体が 28.6% であり、ProliHH では四倍体が 8%、二倍体が 88% でした(原著論文Fig.S3Fですが省略)。
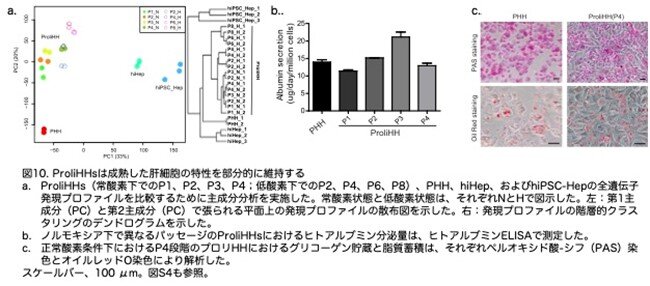
次に、RNA シーケンシング解析によって、正常酸素で解凍し培養したばかりの PHHsとProliHHの間の全体的な遺伝子発現を比較しました。ProliHHが肝遺伝子発現をどの程度維持しているかを検証するために、ヒト多能性幹細胞(hiPSC-Hep)または直接的な転換によってヒト体細胞から得られた HLC(hiHep)を対照として使用しました。注目すべきは、主成分分析(PCA)と階層的クラスタリングにより、ProliHHsが関連グループを形成し、他の細胞とは異なることを明らかにしました(図10a:原著論文Fig.2C)。それにもかかわらず、ProliHHsはPHHsと密接にクラスターを形成しましたが、HLCsからは遠く離れていました(図10a:原著論文Fig.2C)。さらに、ProliHHsは脂肪酸および薬物代謝に関与する遺伝子の発現が豊富であることが分かりました(ここで原著論文Fig.2D、S4B、S4Cが引用されていますが省略しました)。これらのデータは、肝機能遺伝子の発現がProliHHsで保持されていることを示唆しています。肝遺伝子発現に沿って、HMで培養したProliHHsは、アルブミン分泌、グリコーゲン貯蔵、脂質の細胞質内蓄積など、成熟肝細胞のいくつかの機能を示しました(図10b,c:原著論文Fig.2E,2F)。興味深いことに、低酸素培養されたProliHHsも含んで分析すると、すべてのProliHHsが同一のグループに属したにもかかわらず(図10a:原著論文Fig.2C)、低酸素培養した遅いパッセージ(P6以降)のProliHHsは、主要なクラスターからシフトし、肝表現型が弱まったことがわかりました(図10a:原著論文Fig.2C)。これらの結果は、ProliHHsが成熟肝細胞の全部ではないが、いくつかの特性を維持していることを示しています。
5.ProliHHsは二重表現型の状態にある
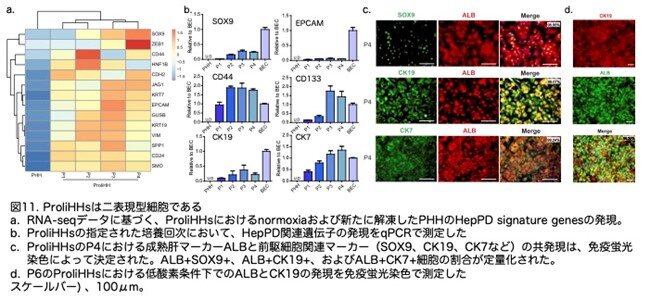
次に、ProliHHsが前駆細胞の特徴を獲得しているかどうかを調べました。ProliHHsでは、ヒト肝細胞からHepPD細胞への変換中にアップレギュレーションされる前駆細胞関連のシグネチャー遺伝子の発現が増加しました。これには、SOX9、EPCAM、CD44、CD133、CK19、およびCK7が含まれます(図11a,b:原著論文Fig.3A,S4D)。SOX9、CK19、およびCK7の免疫蛍光染色は、P4またはそれ以降のほぼすべてのProliHHsがこれらの3つのマーカーに対して陽性であることを示しました(それぞれ96.95%、99.07%、および99.24%; 図11c,d:原著論文Fig.3B,S4E)。
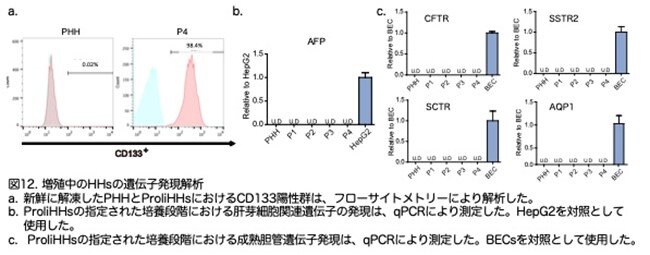
フローサイトメトリー分析では、98%のProliHHsがCD133陽性であることを確認しました(図12a:原著論文Fig.S4F)。特に、ProliHHsは肝芽細胞マーカーであるα-フェトプロテイン(AFP)を発現しなかったため、これらの細胞はHM培養において胎児肝芽細胞として機能する可能性は低いことを示唆しています(図12b:原著論文Fig.S4G)。さらに、嚢胞性線維症膜貫通伝導調節因子(CFTR)、セクレチン受容体(SCTR)、ソマトスタチン受容体2(SSTR2)、およびアクアポリン-1(AQP1)などの成熟胆管の機能遺伝子はProliHHsでは発現していませんでした(図12c:原著論文Fig.S4H)、これはProliHHsが成熟胆管細胞ではないことを示しています。
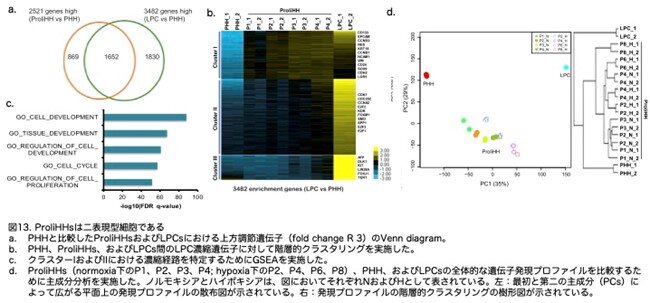
ヒトHepPDsまたはヒト肝前駆細胞の発現プロファイルがないため、著者らはhiPSC由来のLPCs(Shih et al., 2015)を使用して、Normoxia培養されたProliHHsとLPCsの類似性を評価しました。PHHsと比較すると、LPCsでは3,482の遺伝子が有意にアップレギュレーションされ、そのうち1,652(47.4%)はProliHHsでもアップレギュレーションされていました(図13a:原著論文Fig.3C)。PHHs、ProliHHs、およびLPCs間の差次的遺伝子発現のパターンに基づいて、LPCに富む遺伝子は3つのクラスター(Cluster I, II, III)に分けることができました(図13b:原著論文Fig.3D)。特に、遺伝子セット濃縮解析(GSEA)は、クラスターIおよびIIの遺伝子が幹細胞および細胞周期に関連するいくつかの経路で濃縮されていることを確認しました(図13c:原著論文Fig.3E)。これはProliHHsがパッセージ中に前駆細胞関連の特徴を獲得していることを示唆しています。クラスターIIIの遺伝子、例えば以前に報告された前駆細胞関連マーカーであるDLK1、KIT、およびFOXJ1は、ProliHHsでは完全にはアップレギュレーションされていませんでした(図13b:原著論文Fig.3D)。興味深いことに、全体の発現プロファイルが分析されたとき、Normoxiaで培養されたProliHHsは依然としてPHHsに近いクラスターを形成し、LPCsとは違うクラスターに分離されていました(図13d:原著論文Fig.3F)。以前の研究では、WntおよびYap経路が肝細胞から前駆細胞への再プログラミングを促進する機能が明らかにされました。これらの発見に沿って、著者らはWntターゲット遺伝子および保存されたYAPシグネチャー遺伝子がProliHHsで濃縮されていることを発見しました(図は原著論文Fig.S4Iですが省略)。これはHHsからProliHHsへの変換におけるWntおよびYapの可能なメカニズム的役割を示唆しています。特に、低酸素培養されたProliHHsの発現プロファイルを解析したとき、遅いパッセージのProliHHsは前駆細胞様のプロファイルを発現する傾向を示しました(図13d:原著論文Fig.3F)。これらの結果は、ProliHHsが前駆細胞の全遺伝子プロファイルを確立していないにもかかわらず、LPC遺伝子の大部分を発現していることを示唆しています。ProliHHsは成熟肝細胞と肝前駆細胞の間の二重表現型の「中間」状態にあると言えます。
6.ProliHHは成熟状態に戻すことが可能
次に、ProliHHsが可塑性を持ち、成熟した肝細胞の特性を再獲得できるかどうかを解析しました。そこで、早期(P4以前)および遅期(P6以降)のパッセージの培養皿にいっぱいになったProliHHsを取り、3次元培養で10日間肝細胞成熟培地で培養しました(図14a:原著論文Fig.4A)。成熟条件下で、ProliHHsは成熟肝細胞の典型的な形態を形成し、多角形の形状を示しました(図14b,c:原著論文Fig.4B,4C)。特に、一部の細胞はHMで培養したProliHHsでは検出されなかった二核を示しました(図14b:原著論文Fig.4B)。
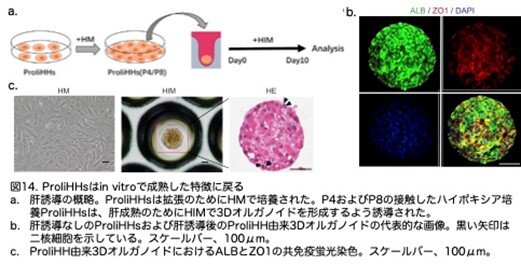
ALB、TTR、HNF4A、AATなどの肝細胞遺伝子は、 ProliHHsが成熟後有意に増加しました(図15:原著論文Fig.4D)。
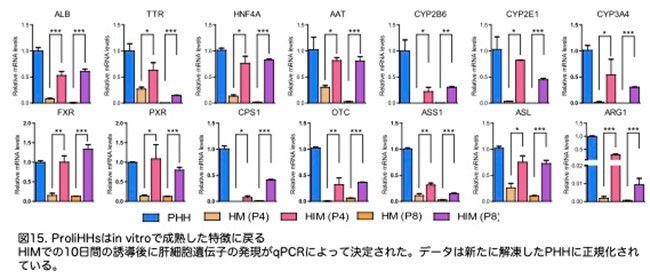
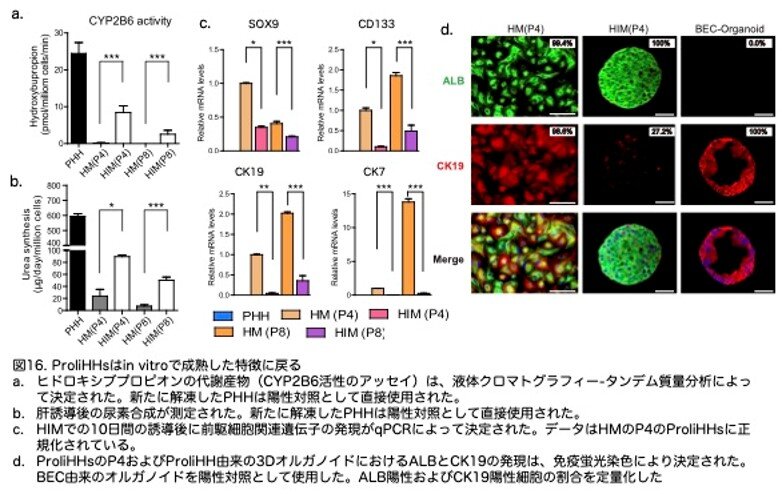
CYP2B6代謝および尿素合成に関与する遺伝子のmRNAレベルの増加と一致して、CYP2B6の代謝および尿素合成は、成熟後のProliHHsで誘導されました(図16a,b:原著論文Fig.4E,4F)。対照的に、SOX9、CK19、CK7などの前駆体関連遺伝子の発現レベルは、qPCRによって示されるように大幅に減少しました(図16c:原著論文Fig.4G)。ALB、CK19、CK7の免疫蛍光染色はqPCRデータを確認し、成熟胆管細胞の形成は見られませんでした(図16c,d:原著論文Fig.4G,S4J)。これらの結果は、ProliHHsが成熟肝細胞に近い状態に戻る可能性があることを示唆しています。
7.複数の個体から作製されたProliHHs
次に、10人の追加の個体からの肝細胞にプロトコルを適用しProliHHsの誘導を試みました。特に、異なる性別、年齢、人種の7人の追加の被験者の肝細胞は、HM培で少なくとも5パッセージ追加で培養できました。興味深いことに、11歳未満の5人の若いドナーからの細胞は、P8で総数が1,000倍から10,000倍に増殖しました(図17a:原著論文Fig.S5A)。しかし、37歳以上の5人の成人ドナーのうち2人からの肝細胞は、P5で約1,000倍にしか増殖しませんでしたが(図17b:原著論文Fig.S5B)、若いドナー細胞の成長曲線と類似の累積成長曲線を示しました(図17a,b,c:原著論文Fig.S5A-S5C)。 これらのデータにより、若い個体の肝細胞がHM培地で増殖する高い能力を持っていることが示唆されました。
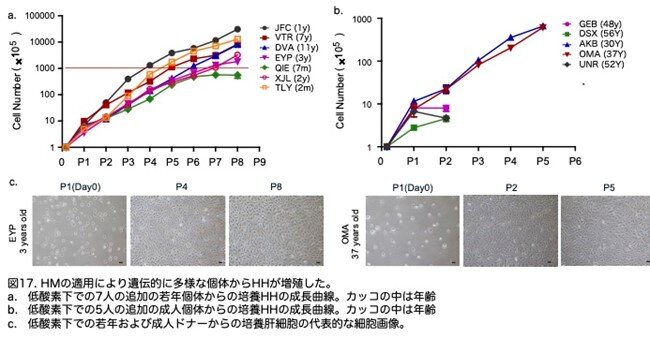
新しいドナーから得られたProliHHsは二表現型であり、肝細胞特異的遺伝子と機能の部分的保持を示しました(図18a-d:原著論文Fig.S5D-S5G)と同時に、前駆体関連遺伝子の発現が増加しました(図18a,b:原著論文Fig.S5D,S5E)。
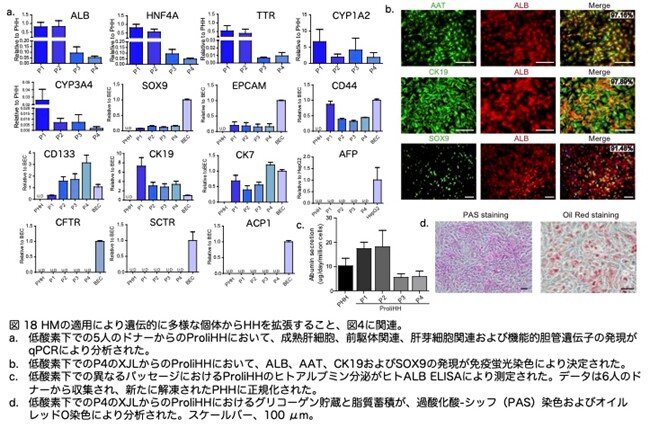
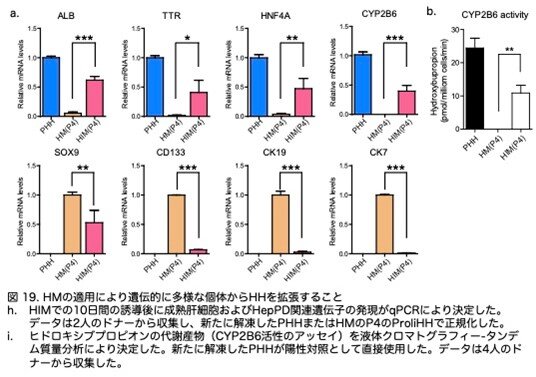
さらに、HIM培地での分化において、ProliHHsはCYP2B6活性などの成熟肝細胞の機能を強化されました(図19a,b:原著論文Fig.S5HおよびS5I)。これらの結果は、HMが遺伝的に多様な個体からHHを増殖させるために使用できることを示しました。
8.移植後のProliHHsのマウス肝臓への効率的な生着
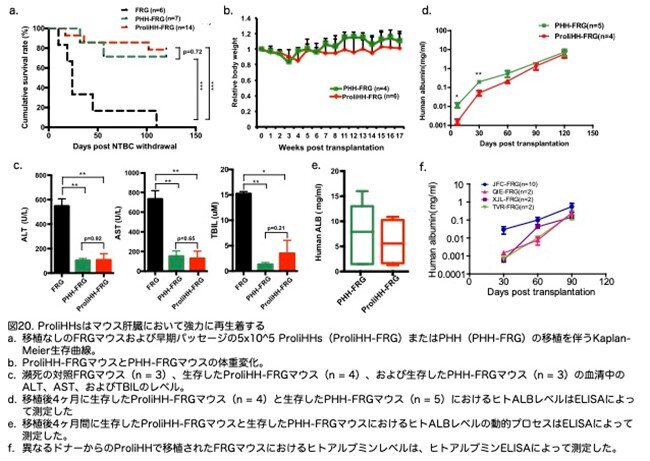
次に、ProliHHsのin vivoでの再生着能を調べるために、免疫不全のFRGマウス(Fah-/-:Rag2-/-: Il2rg-/-)に移植しました。これはヒトチロシン血症タイプIのモデルです。FRGマウスは、2-(2-nitro-4-trifluoro-methylbenzyol)-1,3-cyclohexanedione(NTBC)を投与するか、NTBCの離脱後にPHHを移植しない限り、肝不全で死亡します。したがって、FRGマウスへの移植は、ProliHHsのin vivo機能を解析するための有用な手段です。
すべての肝細胞移植なしのFRGマウスは4ヶ月以内に死亡しましたが、PHH移植を受けた7匹中5匹のFRGマウスは生存しました(図20a:原著論文Fig.5A)。特に、早期パッセージ(P4以前)のProliHHsを移植した14匹中11匹のFRGマウスは4ヶ月以上生存し(図20a:原著論文Fig.5A)、PHHを移植したFRGマウスと類似の生存曲線を示しました(ログランクテスト; p = 0.72)。ProliHHを移植したマウスは、移植後の最初の4週間で体重が減少しましたが、その後体重を回復し安定を保ちました。これは、移植されたProliHHsが病気のFah--/--肝臓の機能を回復させたことを示唆しています(図20b:原著論文Fig.5B)。ProliHH移植を受けたマウスは、PHH移植を受けたマウスよりも1週間遅れて体重が増加しました(図20b:原著論文Fig.5B)。これはProliHHsが移植後に肝機能を支えるために追加の時間を必要とすることを示唆しています。
血清中のアスパラギン酸トランスアミナーゼ(ALT)、アラニントランスアミナーゼ(AST)、および総ビリルビン(TBIL)は、PHH移植およびProliHH移植を受けたFRGマウスの両方で有意に減少しました(PHHとProliHHの間に有意差はありません)。これは、これらのマウスにおける肝機能の改善をさらに示唆するものでした(図20c:原著論文Fig.5C)。マウス血清中のヒトアルブミンの分泌は、ProliHHの移植後に徐々に増加し(図20d:原著論文Fig.5D)、4か月で5.8 ± 4.5 mg/mLに達しました。これはPHHを受け取ったマウスのレベル(7.3 ± 6.1 mg/mL; p = 0.69; 図20e:原著論文Fig.5E)に匹敵しています。さらに、他のドナーからのProliHHを移植した場合、FRG受容体マウスにおいてヒトアルブミンレベルが比較可能な範囲(移植後3か月で約0.1-1 mg/mL)に達することがわかりました(図20f:原著論文Fig.S6A)。特に、PHHを移植されたマウスの血清アルブミンレベルは、ProliHHを移植されたマウスよりも移植後の最初の3か月間で高いことがわかりました(図20e:原著論文Fig.5D)。これは再び、ProliHHが肝機能を回復するのにより多くの時間を必要とする可能性があることを示唆しています。
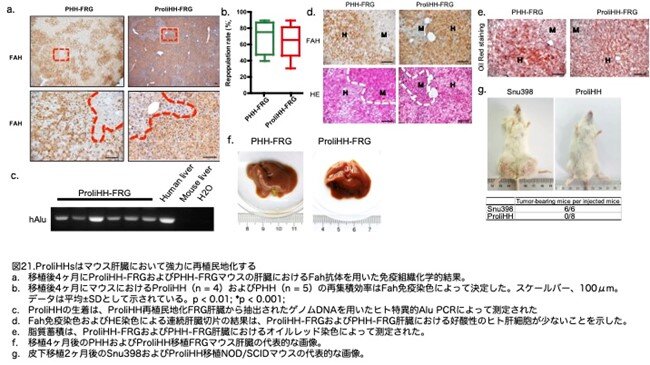
ProliHHの再生着効率を解析するために、移植後4か月で肝臓サンプルを採取しました。Fahの免疫組織化学染色は、ProliHHが生存したマウスの肝実質の64% ± 21.8%に生着したことを示しています(図21a,b:原著論文Fig.5F,5G)。この再生着効率は、PHHの再生着効率に匹敵しました(70.4% ± 21.5%; p = 0.66; 図21a,b:原著論文Fig.5F,5G)。FRGマウスの肝臓におけるProliHHの生着は、ヒト特異的Alu DNA配列のゲノムPCRによってさらに確認しました(図21c:原著論文Fig.S6B)。特に、Fah陽性の再集積したProliHHは、淡い細胞質の好酸性染色を示し(図21d:原著論文Fig.S6C)、脂質の蓄積が増加していることからマウス肝細胞と区別できました(図21e:原著論文Fig.S6D)。これらの観察結果は、PHH再生着肝組織の特徴と一致していました(図21d,e:原著論文Fig.S6C,S6D)。重要なことに、ProliHH移植を受けたFRGマウスでは、移植後4か月で腫瘍は見つかりませんでした(図21f:原著論文Fig.S6E)。さらに、ProliHHは免疫不全マウスにおける皮下異種移植後に腫瘍を形成しませんでした(図21g:原著論文Fig.S6F)。これらのデータは、ProliHHがFRG肝臓に効率的に再生着し、肝損傷の治療において治療効果を持つことを示唆しています。
9.生着後のProliHHの成熟
次に、ProliHHがin vivoでさらに成熟するかどうかを解析しました。免疫蛍光染色は、再生着したProliHHがALBおよびHNF4Aの発現を維持し、CK19およびCK7の発現を停止したことを示しました(図22a:原著論文Fig.6A)。CYP3A4およびGSの中心周辺の発現は、再生着したマウス肝臓において肝ゾーニングが確立されたことを示しています(図22b:原著論文Fig.6B)。また、再生着したProliHHの肝遺伝子発現をヒト特異的プライマーを用いてqPCRで解析しました。再生着したProliHHは、移植後にPHHに匹敵するレベルで、フェーズIおよびII酵素や輸送体等の成熟肝遺伝子の発現が有意に増加しました(図22c:原著論文Fig.6C)。さらに、再生着したProliHHの全肝臓ホモジネートに対してヒト特異的RNAシーケンシング解析を実施し、再生着したProliHHのグローバルな遺伝子発現パターンを評価しました。再生着したProliHHとPHH間の遺伝子発現プロファイルは、それぞれのin vitroの対照間のプロファイルと比較して、より密接な相関がありました(in vivo r² = 0.94 対 in vitro r² = 0.74; 図22d:原著論文Fig.6D)。
再生着したProliHHの成熟度をさらに評価するために、移植された肝臓でヒト特異的な薬物代謝が行われるかどうかを確認しました。そのために、CYP2D6によって行われるヒト肝細胞のユニークな代謝機能を測定しました。これは、典型的な基質であるデブリソクイン(DEB)をその4-OH代謝物(4-OH DEB)に変換します。ProliHHを移植されたFRGマウスは、対照群よりも血清中の4-OH DEBの量が有意に高いことを示しました(図22e:原著論文Fig.6E)。ProliHH移植マウスにおけるDEB代謝データは、他の肝臓ヒト化マウスで報告されたデータに類似していました。これらのデータは、ProliHHがin vivoでヒト特異的な代謝を伴ってさらに成熟したことを示唆しています。
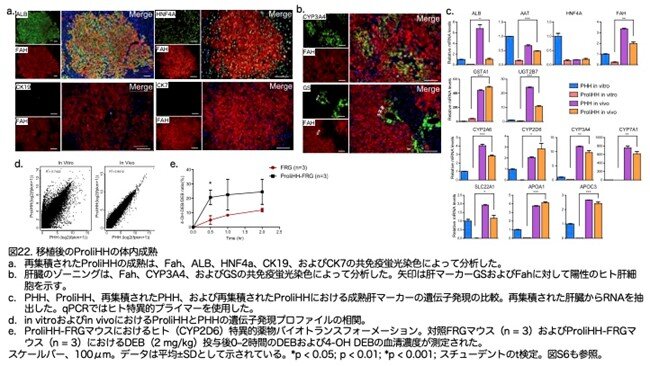
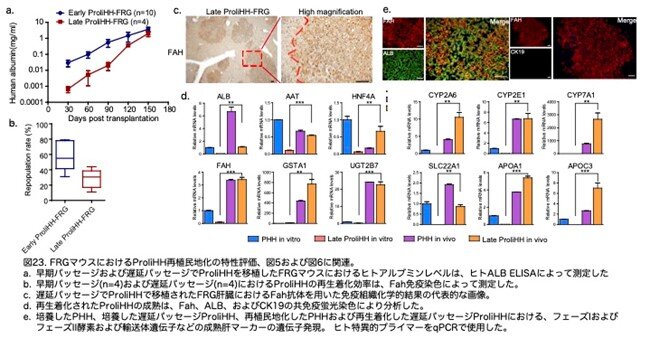
最後に、著者らは遅いパッセージ(P6以降)のProliHHをFRGマウスに移植しました。血中のヒトアルブミンは、移植されたProliHHの再生着をチェックするために測定しました。 ヒトアルブミンの血清レベルは、遅いパッセージのProliHHを移植したFRGマウスで安定して増加しました (図23a:原著論文Fig.S6H)。 興味深いことに、ヒトアルブミンのレベルは、早いパッセージのProliHHを移植したマウスと比較した場合、遅延した動態を示しました。それにもかかわらず、ヒトアルブミンのレベルは、移植後20週間で1.9±1.2 mg/mLという十分高いレベルに達し、これは早いパッセージのProliHH移植マウスにおけるヒトALBレベルとあまり変わりない範囲にありました (図23a:原著論文Fig.S6G)。 さらに、FAH酵素の免疫組織化学(IHC)染色は、遅いパッセージのProliHHがFRG肝臓の29% ± 12%を再生着できることを示しました (図23b,c:原著論文Fig.S6HおよびS6I)。 重要なことに、遅いパッセージのProliHH再生着肝臓では、アルブミン、AAT、およびHNF4aを含む肝細胞遺伝子の発現が著しく増加しましたが (図23d:原著論文Fig.S6K)、胆管細胞遺伝子CK19の発現はほぼ検出不可能でした (図23e:原著論文Fig.S6J)。 これらのデータは、遅いパッセージのProliHHが再生着能力を維持し、時間をかければin vivoで成熟できる可能性があることを示唆しています。
10.要約と考察
PHHの培養はニーズがあるにもかかわらず長い間解決できていません。この論文で、HHを増殖可能な二重表現型の状態に変換するためのin vitro培養プロトコルを確立しました。成熟肝細胞と肝前駆細胞の両方のマーカーを発現し、これらの細胞は最大10,000倍まで増殖できました。ProliHHは、血漿タンパク質分泌、グリコーゲン貯蔵、脂質蓄積を含む成熟肝細胞のいくつかの機能的特性を保持していました。これらの細胞は、肝細胞成熟培地でさらに成熟することがわかりました。重要なことに、ProliHHはin vivo移植後に肝臓の約60%を占めるまで再生着する驚くべき能力を示しました。パッセージ中に、成熟に関連するいくつかの遺伝子が著しく減少し、逆に前駆細胞に関連する遺伝子が増加したことは注目に値します。これは、ProliHHが数を増やすにつれて、その成熟能力が影響を受けることを示しています。興味深いことに、このことはFRG肝臓におけるProliHHの再生着の減少と関連しています。
以前のプロトコルでは、in vitroでのHHの約10倍の増殖が示されました。一方、今回のプロトコルでは、HHはP8で最大10,000倍に増殖可能でした。 肝細胞移植は、特に先天性代謝異常を持つ乳児や幼児の治療において、肝移植の有望な代替治療法です。1人の患者に移植される生きた細胞の数は約109ですが(Dhawan et al., 2010)、 著者らのプロトコルに従えば、商業的な一次ヒト肝細胞から109の移植可能な肝細胞を得ることができます (3または4回のパッセージで約100倍に拡張することにより、1バイアルあたり109肝細胞が得られます)。筆者らはHHの増殖のためのプロトコルを開発しましたが、肝疾患の治療のための細胞源としてさらに発展させることができるかもしれません。
Wnt3aはHHの増殖の開始に不可欠のようです。Wnt3aの除去は、ヒト肝細胞の増殖を劇的に減少させました。ProliHHにおいてWntのターゲット遺伝子のかなりの発現上昇が見つかりましたが、肝臓の再生中の肝細胞増殖および再プログラミング におけるWnt経路の重要な機能と関連しているようです。 興味深いことに、古典的なWntアゴニストであるCHIR99021は、ヒト肝細胞の増殖においてWnt3aの代わりにはなりませんでした。これは、Wnt3aが古典的なWntシグナル伝達を活性化するだけでなく、Hippo/YAP経路などの他の経路ともクロストークするためであると考えられます (Azzolin et al., 2014)。 実際、GSEA分析は、ProliHHにおいてはPHHよりも、YAPシグネチャー遺伝子が豊富であることを明らかにしました。YAPシグナル伝達が肝臓における前駆体の増殖誘導にも重要であることを考慮すると、WntおよびYAP経路の両方がin vitroでProliHHsの誘導に重要な機能を持つ可能性があります。
ProliHHsは、約1か月間の培養後にP21やP53などの細胞周期停止遺伝子の発現が増加し、細胞老化により増殖を停止しました。持続的なWnt経路の活性化がARFおよびP53に依存した老化様表現型を誘導することが報告されています。しかし、Wnt3aと老化の関連性は今後さらなる検討が必要です。特に、低酸素状態が老化を大幅に軽減できることを示しましたが、低酸素状態がmTOR経路の抑制によってP21誘導の老化を抑制することが報告されていますので、mTOR阻害剤がProliHHsのさらなる長期的な増殖を維持できるかどうかを確認する必要があります。
最近、マウスおよびヒトの肝細胞が肝損傷後にin vivoでHepPDsに再プログラムできることが示されました。著者らの研究で得られたヒト肝細胞由来の増殖する二重表現型細胞は、ヒト肝細胞が細胞の可塑性を示すという結論をさらに支持するかもしれません。特に、最近の2つの研究では、小分子が齧歯類の肝細胞を肝前駆体様細胞に再プログラムできることが示され、これらの細胞が転写および機能レベルで肝前駆体の特徴を示しました。興味深いことに、2つの研究からの肝前駆体様細胞は、ALBやCYP450遺伝子などの成熟肝細胞のマーカーを表現せず、グリコーゲン貯蔵などの成熟肝細胞の機能も持っていませんでした。対照的に、著者らの研究で生成されたProliHHsは、肝細胞遺伝子と機能の発現を保持していましたが、PHHsよりも低いレベルでした。齧歯類とヒトの増殖肝細胞の違いは、in vitroでの肝細胞から前駆体への転換において異なる段階が必要なことを示しているか、あるいは単に種の違いを反映しているかもしれません。重要なことに、ラットCLiPsとヒトProliHHsは、それぞれ尿キナーゼ型プラスミノーゲンアクチベーター(uPA)/重度複合免疫不全(SCID)およびFRGマウスに移植されたときに、病気の肝臓に効率的に再生着できました。しかし、レシピエント動物モデルとドナー細胞の違いを考慮すると、ラットCLiPsとヒトProliHHsの治療効果を直接比較することは困難です。
PHHの特徴の1つは、移植後の顕著な再生着化能力です。分化または分化転換によって生成されたヒトHLCsは、in vitroモデリングに有用な多くの成熟肝細胞表現型を再現しています。しかし、これらの肝再生着化効率は限られています。対照的に、成熟肝細胞の表現型を部分的に維持したProliHHsは、損傷した肝臓の約60%に再生着し、in vivoでさらに成熟することができ、肝再生療法の可能性を示唆しています。いくつかの肝疾患においては、10%の再生着化が治療効果を示すのに十分であるため(Dhawan et al., 2010)、ProliHHsのそのような再生着化能力は、これらの臨床的応用にとって注目すべき価値があります。さらに、PHHs、ProliHHs、およびHLCs間のトランスクリプトームをさらに解析し、肝細胞生着化のための重要な分子メカニズムを明らかにすることは興味深いと思われます。結論として、ProliHHsのプロトコルは、HH培養に関する洞察と治療目的のための細胞の供給源を提供することができます。さらに、ProliHHsは成熟肝細胞に戻ることができることが、成熟肝細胞遺伝子の発現の上昇によって示されています。これらの細胞を用いて、薬物代謝、肝炎ウイルス感染、および肝疾患モデリングの研究をin vitroで行うことが可能と考えられます。
次はコラム第20話です
一つのテーマに関して、一つのグループからの報告だけだと、眉唾物の可能性がありますが、異なったグループからの報告が出ると、内容の信憑性は高くなります。それであれば肝前駆細胞は本当に実現できると思われます。それで、次回は「Katsuda et al. Generation of human hepatic progenitor cells with regenerative and metabolic capacities from primary hepatocytes. Elife 8:e47313, 2019」を紹介しようと考えていますが、この論文では小分子化合物による幹細胞誘導の話です。その小分子化合物はこの論文でいきなり出てきたのではなく、その前に同じグループから2つの論文が出ていました。そのうちの1つの論文「Kawamata and Ochiya Generation of genetically modified rats from embryonic stem cells. Proc. Natl, Acad. Sci. USA. 107:14223-14228, 2010」を、コラム第20話番外編1として次回紹介したいと思います。