肝臓ヒト化マウスの歴史 第18話 番外編
初代ヒト肝細胞を用いた肝臓ヒト化マウスの作製
今回は、ヒト初代肝細胞を用いた肝臓ヒト化マウス作製の一つですが、紹介を忘れていましたので第18話番外編として「Bissig et al. Repopulation of adult and neonatal mice with human hepatocytes: A chimeric animal model. Proc. Natl. Acad. Sci. USA. 104:20507-20511, 2007」を紹介します。
1.研究目的
in vitro培養された一次細胞は、しばしば生体内の生物学的機能を反映しません。例えば、培養されたヒト肝細胞は、肝臓内の肝細胞とは異なる遺伝子発現プロファイルを示します。そのため、マウス肝臓にヒト肝細胞を再導入する試みが数多く行われてきました。しかし、実験動物モデルにおいて、生物学的機能を保持したままヒト細胞を培養する技術的な課題は依然として残っています。
最近まで、ヒト肝細胞の再増殖に適合していたマウスモデルは、urokinase型プラスミノーゲン活性化因子(uPA)マウスモデルのみでした。出血性疾患の研究のために開発されたこのマウスモデルは、アルブミンプロモーターから発現する uPA の追加コピーを含んでいます。予想通り、このマウスは線維素溶解能の増加が見られましたが、肝毒性も認められ、通常、腸出血や肝不全により子マウスが死亡していました。驚くべきことに、生存した少数マウスでは、導入したはずのuPA遺伝子が欠失した肝細胞のクローン拡大が観察されました。この結果は、成長優位性を持つ肝細胞が選択的に拡大するとの以前の観察結果を裏付けました。数年後、同系および異種(ラットとウッドチャック)の肝細胞移植が報告されました。同様に、B型およびC型肝炎感染に感受性のあるヒト肝細胞がuPAマウスに移植されました。uPAマウスは肝細胞の異種移植に適合しますが、出血による高い死亡率が主要な欠点であり、その結果、移植に必要な手術が制限されています。さらに、移植は狭い時間枠(生後 5~12 日)内に実施する必要があり、体細胞の復帰変異により生着が阻害されてしまう可能性があります。また、このマウスは繁殖力が低く、ヒト肝細胞の再移植後もしばしば健康状態を損なう傾向があります。
Grompe らは、フマル酸アセトアセテートヒドロラーゼ(FAH)を欠失し、肝細胞内での毒性のあるチロシン代謝産物の蓄積を引き起こす遺伝性チロシン血症I型のマウスモデルを開発しました。このマウスは、エクソン5の完全欠失により復帰変異が起こらないため、優れた再移植モデルとされています。さらに、化合物2-(2-ニトロ-4-トリフルオロメチルベンゾイル)-1,3-シクロヘキサンジオン(NTBC)は、FAHより上流の酵素の活性を阻害し、肝毒性代謝物の蓄積を防止します。同系肝細胞による再増殖が盛んであるため、著者らは Fah-/- マウスを用いてヒト肝細胞を移植することにしました。
最近、Azuma らは、免疫不全の Fah-/- マウスにヒト肝細胞を移植できることを報告しました (コラム第10話)。しかし、生着は、まず uPA を発現するアデノウイルスで治療したレシピエントでのみ観察されました。ここでは、免疫不全(B細胞、T細胞、NK細胞を欠如する)fah-/-マウスへのヒト肝細胞の再生着に関する彼らの観察結果を再現し、さらにuPAの発現が不要な改変を加えました。移植されたヒト肝細胞は、レンチウイルスベクターで導入された転移遺伝子の持続的な発現を示しました。さらに、新生児マウスへのヒト肝細胞の再生着を効率的に行うための、単純な肝内移植法の開発についても報告します。
2.方法論
(1)マウス
Fah-/-マウス(8)を、The Jackson Laboratoryから入手したIl-2rγ-/-(B6.129S4-Il2rgtm1Wjl/J)と、Taconic Farmsから入手したRag2-/-マウス(RagN12)と交配させました。遺伝子型解析は、他の報告で記述されたものと同じプライマーと条件を使用するか、またはベンダーが提供するプロトコルに従って行いました。マウスは、飲用水に7.5μg/mlのNTBC(100%)を添加した環境で飼育しました。NTBCの濃度ですが、原文では7.5mg/mlとなっていますが、明らかに間違いです。なぜか他の論文でも同じ間違いが見られ要注意です。マウスは、温度と湿度を管理した動物飼育施設で、12時間明暗サイクルの下で飼育しました。
(2)成体マウスと新生児マウスの移植
肝細胞はCellzDirectから購入し、肝細胞は製造元の培地で氷上輸送された細胞ペレットとして送付されました。到着後、細胞はHBM(Cambrex Bio Science)50 mlで1回洗浄し、移植まで氷上で保管しました(分離後48時間以内)。成体マウスは以前報告された方法(16)に従って移植しました。要約すると、マウスは、イソフルランで麻酔し、加熱パッド上に保持しました。その後、腹部中央の切開を行い、脾臓を注入用するために露出しました。脾臓の下極に、27ゲージの注射器を使用して、0.2-1×10⁶の肝細胞を含む200 µlを注入しました。その後、注入部位(腹筋層)の閉鎖は4-0シルク縫合糸で結紮し、皮膚はステープラーで固定しました。移植後、NTBCは直ちに中止しました(7.5 μg/mlのコロニー維持濃度の25%、12%、6%ずつ、各ステップで2日間投与後、薬剤を中止)。7~10 日後、再びマウスにNTBCを 3 日間投与し、2 回目の投与中止(サイクリング)を行いました。体重の増加やヒトの血液タンパク質の ELISA レベルに応じて、マウスはさらに数回のサイクリングを行いました。
新生児への移植では、27ゲージの注射器を使用して左下葉に0.5~1×10⁶の肝細胞を50 µlの量で経皮的に注射しました。NTBCは、移植直後に6%まで段階的に中止しました。その後、子マウスを養育用のICR雌マウスに移し、薬剤を完全に中止しました。マウスはNTBCで100%、25%、12%、6%、0%のステップでサイクル化しました。これらの動物実験は、米国の動物福祉法および規制に準拠して実施され、当施設の動物実験委員会(IACUC)の承認を受けています。
(3)マウスへの薬剤投与
0.69 Mの濃度でClodronate liposomesを合成しました。移植の24~48時間前に、Clodronate liposomes 100 µlを腹腔内投与しました。Kupffer細胞の恒常的な減少を伴う実験では、最初の投与を毎週繰り返しました。Nafamostat Mesilate (Futan)を 1.5 mg/ml 0.9% NaCl に溶解し、この溶液 200 µl を 1 日おきに腹腔内注射しました。
(4)ヒト肝細胞のレンチウイルス導入
CMV プロモーターの下の GFP を、自己不活性化型第 3 世代レンチウイルスベクター(Cell Genesys 社より提供)にクローニングしました。その後、肝細胞1 ml(10⁶細胞)を、293T細胞における生物学的滴度2 × 10⁸トランスデューシングユニット/mlの濃縮レンチウイルス10 µlと、超低付着プレート(Corning)で3時間培養し、細胞をHBM(Cambrex Bio Science)50 mlで3回洗浄後、直ちに移植しました。収穫した肝臓は4%パラホルムアルデヒドで固定し、凍結保存後、切片化し、DAPIで5分間直接染色しました。画像は共焦点顕微鏡(Leica Microsystems)で撮影しました。
(5)その他の方法
マウス血液中のヒトタンパク質の測定、免疫組織化学、インサイチュハイブリダイゼーション、については省略します。
3.移植されたヒト肝細胞の特性解析
ヒト肝細胞の移植のため、まずFah-/-マウスと成熟したBリンパ球とTリンパ球が欠如したrecombination activating gene 2 KO(Rag2-/-)マウスを交配し、免疫不全マウスを作製しました。さらに、この二重 KO マウスを、B 細胞および T 細胞の発達障害があり、NK 細胞の発達が完全に阻害されている IL-2 受容体、共通 γ 鎖 KO (Il-2rg-/-) マウスと交配しました。この三重 KO マウスにより、ヒト細胞の生着効率が向上することが報告されています (Shultz et al. Nature Rev 7:118 -130, 2007)。
さらに、薬物療法により免疫系の他の2つの成分を阻害しました。最初の成分である補体系は、プロテアーゼ阻害剤のナファモスタットメシル酸塩(フタン)の腹腔内注射により阻害しました(コラム第8話参照)。2つ目は、肝マクロファージであるクッファー細胞の除去を目的とし、移植前にマウスにクッファー細胞を効率的に減少させることで知られるビスホスホネートであるクロドロネートを含むリポソームを投与しました(Van Rooijen et al. (1996) Hepatology 23:1239 -1243, 1996)。同じドナー由来のヒト肝細胞を、すべての実験群の動物に脾内注射により移植しました。移植後、NTBCを中止し、マウス体重の変化を2日ごとにモニタリングしました。体重が一定または増加している場合は、水分補給の状態がバランスよく保たれていることを反映しており、生着が成功したことを間接的に示す指標となります。肝細胞移植を受けず、NTBC の投与を中止した Fah-/-マウスは、徐々に体重が減少し、4~10 週間で死亡します。免疫状態の異なる動物における 6 件の独立した移植のデータから、肝細胞の移植を成功させるには、B 細胞、T 細胞、および NK 細胞の枯渇が必要かつ十分であることが確認されています。
生着したヒト肝細胞について、肝臓における FAH 発現を分析しました。これは、レシピエントマウスがFAH遺伝子を欠失しているため、FAHを発現しているヒト細胞の生着を示す指標となります。FAH 陽性のヒト肝細胞は、すべての肝葉の肝小葉全体、門脈周囲から中心葉にかけて検出されました(図1A)。細胞は小さなクラスターとして発見され、生着の成功後に選択的に増殖したことを反映しています。移植後 3 ヶ月で、マウス肝臓の一部の領域では 50% がヒト肝細胞で占められていました(図1C)。しかし、同じ肝臓の異なる領域における再増殖の程度はさまざまで、マウス肝臓の 10~20% 程度がヒト肝細胞で再生着していました。興味深いことに、ヒト細胞クラスターの間にはアポトーシスを起こしたマウス肝細胞はほとんど見られませんでしたが、NTBC を投与しなかったマウスでは、切片の他の部分でアポトーシスが頻繁に認められました(データ未掲載)。ヒト細胞クラスターが時間の経過とともに拡大するにつれて、マウス細胞はヒト細胞の間に拡大し、ヒト細胞とマウス細胞が混在するクラスターが形成されました。

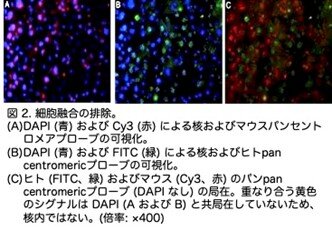
クラスター内のヒトとマウスの肝細胞を形態学的に区別することは困難でした。移植したヒト肝細胞が既存のマウス肝細胞と融合したかどうかを確定するため、ヒトとマウス特異的なセントロメア配列を用いたin situハイブリダイゼーションを実施しました。図2(原著論文Fig.2)は、マウスとヒトのマーカーの染色重なりが欠如していることから、融合が認められなかったことを示しています(図2C)。ヒト肝細胞は 7 つの葉すべてで検出され、被膜下局在の傾向が見られました。しかし、肉眼的には、これらのクラスターはマウス組織と区別がつきませんでした。
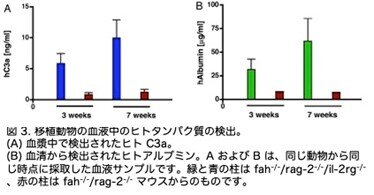
さらに移植マウスにおけるヒト血清成分について分析を行いました。補体カスケードの一員であるヒト血漿 C3a (図3A)およびヒト血清アルブミン(図3B)の測定結果を示します。両方のヒトタンパク質は、時間の経過とともに同程度増加しましたが、同じドナーの肝細胞を移植した対照動物(Fah-/-:Rag2-/- ダブル KO)では、バックグラウンドレベルにとどまっています。同じドナーからの凍結保存肝細胞も、生存率は低下したものの(トリパンブルー 60%)、トリプル KO マウスにうまく生着しました。次に、ヒト肝細胞が、トランスジェニック遺伝子を含むレンチウイルスベクターによって in vitro で形質導入され、移植後に in vivo でその遺伝子を発現できるかどうかを検証しました。移植2ヶ月後、Lenti-GFP(GFP カセットを運 ぶレンチウイルス)によって形質導入されたヒト肝細胞は、トランスジェニック遺伝子の強力な発現を示しました(図 4)。
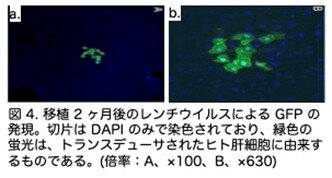
以上から移植し生着したヒト肝細胞は、正常な生物学的機能を発揮し、外来遺伝子を発現できると結論づけられます。
4.新生児移植
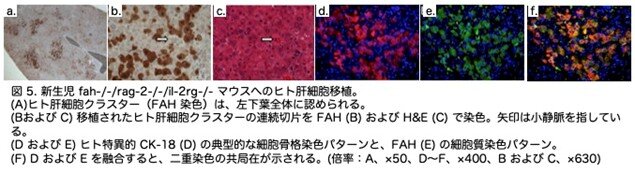
新生児の肝臓は、成人の肝臓よりも分裂する肝細胞を多く含んでいます。この増殖環境は、生着したヒト肝細胞の増殖に有利である可能性があります。しかし、新生児マウスは脾臓内移植を行うことができません。そこで、新生児肝臓の左下葉(left lower lobe:LLL)に経皮注射を行うという、ヒト肝細胞の新生児移植技術を開発しました。移植2ヶ月後に、マウス血液中のヒトタンパク質の測定および肝臓の免疫組織化学検査により、生着の程度を評価しました。図5は、ヒト特異的サイトケラチン(CK-18)と FAH の発現の一致(D~F)を示しています。15 匹中 11 匹(73%)の動物で、ヒト肝細胞が肝臓に生着しました。興味深いことに、FAH 免疫染色では、注射部位だけでなく、LLL 全体にヒト肝細胞のクラスターが観察されました(図 5A)。これらのクラスターは、LLL の1 匹のマウスを除き(すぐ隣にある右上肝葉にクラスターが見られた)、マウスの肝臓の他の葉では観察されませんでした。ヒト肝細胞は、脾臓内に移植した成体マウスで観察されたのと同様に、マウスの細胞の間に統合されており、H&E 染色では後者と区別することができませんでしたF(図 5C)。
5.要約と問題点
著者らは、B 細胞、T 細胞、および残存 NK 細胞活性を欠くマウスにおいて、ヒト肝細胞の再生着に成功した手法の開発について報告しています。成体動物における移植の成功率は 45% から 100% でした。驚くべきことに、生存率 60% の凍結保存肝細胞でも、4 匹のマウスのうち 3 匹に移植することができました。同様に、ドナーの年齢(36~71歳)や性別も重要ではありませんでした。現在、移植の効率を決定する要因は明らかになっていません。
キメラマウス肝臓におけるヒト肝細胞の寄与の正確な程度を測定することは困難ですが、移植された肝臓の切片をヒト特異的マーカーで検査した結果、10~20%がヒト由来であると推定されます。最大再生着率は、より後の時点(3 ヶ月後)でより高くなる可能性があります。移植した細胞の量によっては、Fah-/- マウスにおけるヒト肝細胞の局所的な拡大にはより長い時間がかかる場合があります。さらに、同じ肝小葉内で、マウス肝細胞に対するチロシン前駆物質の毒性が低下するため、ヒト肝細胞の局所的な増殖は数週間後に鈍化する可能性があります。この仮説は、選択(NTBC の投与中止)中に、ヒト細胞クラスターの周囲では、肝臓の他の部分よりもマウス肝細胞のアポトーシスが少ないという観察結果によって裏付けられています。これはFAH活性を有するヒト肝細胞が、マウス肝細胞内に蓄積した毒性物質を代謝するためと考えられています。その結果、ヒト細胞はマウス細胞に対する成長上の優位性を徐々に失っていきます。この発見は、uPA マウスで示されたように、Fah-/- マウスではヒト肝細胞が連続的に増殖するのではなく、マウス肝細胞の中に散在している理由も説明されています(図 1 および 5)。したがって、キメラ現象は臓器レベルだけでなく、肝臓のすべての腺房で観察されます。uPAマウスでは、トランスジーンが発現している限り、マウス肝細胞の成長不利が持続します。一方、Fah-/-マウスでは、この成長不利は毒性のある代謝産物量とNTBCの使用に依存します。
「斑状」の免疫染色(CK-18 および FAH)を伴う腺房レベルのキメラ現象は、細胞融合の可能性を疑わせるものでした。マウス骨髄および肝細胞で観察されたような、マウスとヒトの細胞の融合も、同様の斑状の染色パターンを示す可能性があります。さらに、最近、胚様体由来のサル細胞が、細胞融合によって uPA マウスの肝臓で再増殖することが明らかになりました 。しかし、著者らの in situ ハイブリダイゼーションの結果は、Fah-/-マウスへのヒト肝細胞の生着および再増殖は、細胞融合によるものではないことを示しています。この結果は、Azuma らによる最近の研究結果と一致しています (コラム第10話参照)。
ヒト肝細胞は、これまで報告されているように、ex vivo で容易に形質導入できることが示されています(コラム第10話および第13話参照)。さらに重要なことは、移植後、トランスジェニック遺伝子が in vivo で強力に発現することです。この概念実証実験は、この動物モデルが、ウイルスベクターによる遺伝子の形質導入および持続的発現に適していることを示しています。
本研究では、ヒト肝細胞を新生児の肝臓に移植する効率的な方法(移植した子鼠の73%で成功)を示しました。新生児の肝臓は成人肝臓に比べて分裂する肝細胞がはるかに多く存在します。この増殖環境は、移植されたヒト肝細胞の増殖に有益である可能性があります。出生直後の脾臓内肝細胞移植は技術的に困難であるため、ヒト肝細胞の代替的な肝内移植法が開発されました。新生児に肝内注射を行うことで造血幹細胞を移植できることが示された研究に刺激され、著者らは肝内注射によるヒト肝細胞移植の可能性を探りました。この方法は、従来の脾臓内移植法よりも技術的に容易であり、普及が期待されます。加えて、注射部位だけでなく、LLL 全体において生着が認められました。生着および増殖のパターンは、脾臓内肝細胞移植と同等であり、注射した葉内で最大 50% の再増殖率も認められます。再増殖は肝臓の 35% を占める LLL に限定されるため、移植3ヶ月後のヒト肝細胞の推定量は、脾臓内移植(20%)よりも有意に低い値でした(7%)が、少なくとも 2 つの他の葉(右上葉および左上葉)に注入することも考えられ、その場合は肝臓の3分の 2 に増加することが期待できます。新生児期肝内移植の利点の一つは、動物に術後癒着が生じない点です。癒着は動物に害を及ぼすことは稀ですが、その後の手術介入を制限する傾向があります。脾臓内移植を受けた動物の大多数とは異なり、新生児期移植後には部分的肝切除がより容易に実施可能となります。
著者らの実験が終了した後、Azumaら(コラム第10話)は、アデノウイルス発現型uPAで前処理されたFah-/-マウスへのヒト肝細胞の移植に成功したことを報告しました。彼らの研究と著者らの研究との主な違いは、uPA を発現するアデノウイルスによる追加の治療ステップが必要なかったことです。この操作により、アデノ uPA ベクターによる導入によって事前に抗体が作られるため、移植されたマウスをアデノウイルスベクターによるさらなる操作に使用することが制限されます。Azuma らの研究と同様、私たちの研究でも、再構成されたヒト肝細胞はマウス肝細胞と融合しませんでした。さらに、ヒト肝細胞は GFP を含むレンチウイルスベクターで導入可能であり、移植後もその発現が持続することを示すことができました。明らかに、移植マウスにおけるヒト肝細胞の程度を高めることが望ましいでしょう。
結論として、Fah-/-:Rag-2-/-:Il-2rg-/- トリプル KO マウスは、移植前または移植後の追加治療を必要とせずに、ヒト肝細胞移植の適切なレシピエントであるということを実証しました。ヒト肝細胞の再増殖は細胞融合とは無関係であり、ウイルス導入後に外来遺伝子が効率的に発現できることを示しました。さらに、マウス肝臓へのヒト肝細胞の効率的な再生着につながる、簡単な新生児移植法が開発されました。ヒト肝細胞で再構成されたマウスは、薬物代謝の研究や遺伝子治療戦略の追求に新たな可能性をもたらすと思われます。
次はコラム第19話です
すでにいいデータが出ている多くの論文を紹介していますので、今回のこの論文の新しさには気づきにくいと思われます。この論文ではっきりした3つのポイントを指摘しておきたいと思います。第1は、コラム第8話のTatenoらと同様に補体系尾阻害剤フタンを使用している点です。しかし、使用により具体的にどう改善されたかが記載されていません。その後の論文では、フサンは使用されていませんし、効果はなかったと思われます。第2の点は、クロドロネートを含むリポソームを投与によるクッファー細胞の除去です。これも、その後の論文ではやはり用いられていませんし、本論文でも具体的効果は記載されていません。従来用いられている免疫不全状態で十分ヒト肝細胞は生着できると思われます。第3の点は、コラム第10話で示されたように、生着効率を上げるためアデノウイルス発現型uPAの前処理が必要かどうかです。これは本論文で、必要ないと記載されています。しかし、あえて言えば、使用した時としていない時のデータがなく、本当のところは分かりません。しかし、効果があったとしても僅かではないでしょうか。このように技術が確立されている中で、いろいろな試行錯誤が行われ、最後に残るのは本当に重要な技術だけになるようです。
さて次回は、今まで一番ありそうで論文が出てこなかったもので、肝前駆細胞の話です。これまでPirmary human hepatocyte (PHH)を免疫不全マウスに移植したあとその肝臓からヒト肝細胞を回収したのが「マウス継代一次ヒト肝細胞(mouse-passaged primary human hepatocytes:mpPHH)」(コラム第13話)、多能性幹細胞から分化誘導したのが「hepatocyte-like cell (HLC)」(コラム第14話、15話、16話、17話)、線維芽細胞から誘導したのが「human induced hepatocyte(HIP)」(コラム18話)、そして次回の肝前駆細胞から得られたのが「proliferating human hepatocyte (proliHH)」となります。命名を見るだけで頭がおかしくなりそうです。「Zhang et al. In vitro expansion of primary human hepatocytes with efficient liver repopulation capacity. Cell Stem Cell 23: 806-819, 2018」を紹介します。